niveaux de structure des protéines
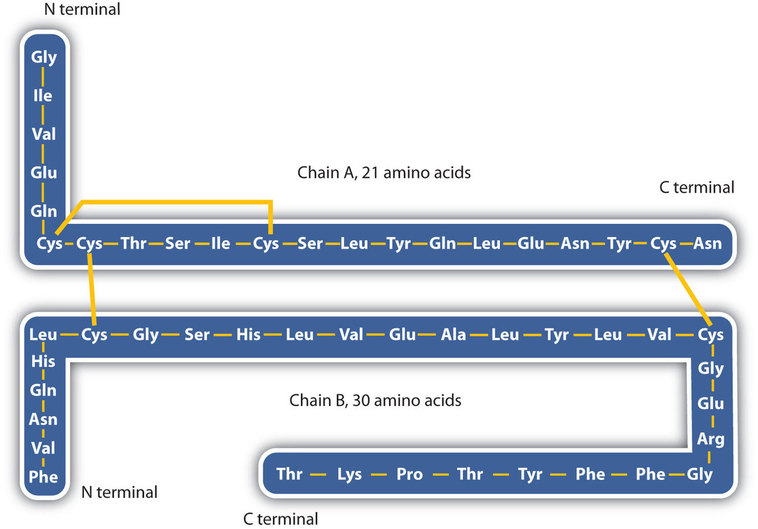
la structure des protéines est généralement décrite comme ayant quatre niveaux organisationnels. Le premier d’entre eux est la structure primaire, qui est le nombre et la séquence d’acides aminés dans la ou les chaînes polypeptidiques d’une protéine, en commençant par le groupe amino libre et maintenu par les liaisons peptidiques reliant chaque acide aminé au suivant. La structure primaire de l’insuline, composée de 51 acides aminés, est illustrée à la Figure \(\PageIndex{1}\).,
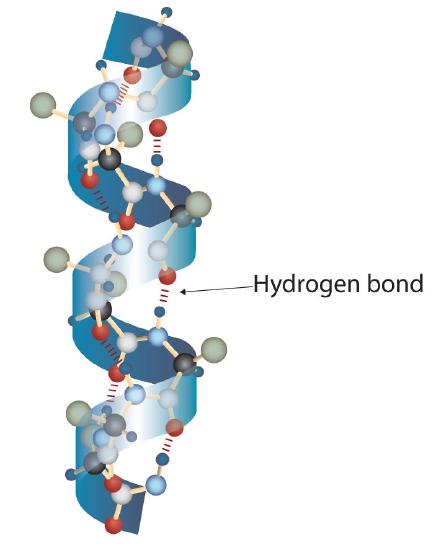
Une molécule de protéine n’est pas un hasard enchevêtrement de chaînes polypeptidiques. Au lieu de cela, les chaînes sont disposées dans des conformations uniques mais spécifiques. Le terme structure secondaire fait référence à la disposition fixe de l’épine dorsale polypeptidique., Sur la base d’études aux rayons X, Linus Pauling et Robert Corey ont postulé que certaines protéines ou portions de protéines se tordent en spirale ou en hélice. Cette hélice est stabilisée par liaison hydrogène intrachaïne entre l’atome d’oxygène carbonyle d’un acide aminé et l’atome d’hydrogène amide quatre acides aminés en haut de la chaîne (situé au prochain tour de l’hélice) et est connue sous le nom d’hélice α droitière. Les données de rayons X indiquent que cette hélice fait un tour pour 3,6 acides aminés, et les chaînes latérales de ces acides aminés projettent vers l’extérieur de l’épine dorsale enroulée (Figure \(\PageIndex{2}\))., Les α-kératines, présentes dans les cheveux et la laine, sont exclusivement de conformation α-hélicoïdale. Certaines protéines, telles que la gamma globuline, la chymotrypsine et le cytochrome c, ont peu ou pas de structure hélicoïdale. D’autres, tels que l’hémoglobine et la myoglobine, sont hélicoïdales dans certaines régions, mais pas dans d’autres.
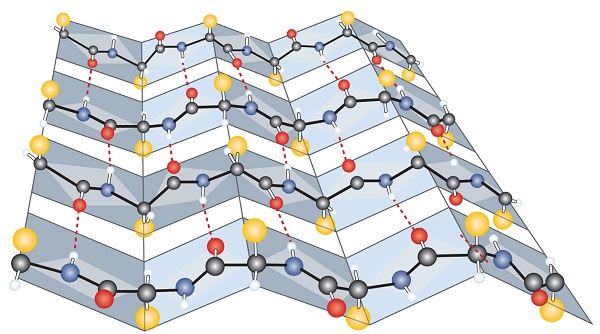
Un autre type commun de structure secondaire, appelé conformation de feuille β-plissée, est un arrangement en forme de feuille dans lequel deux ou plusieurs chaînes polypeptidiques étendues (ou régions séparées sur la même chaîne) sont alignées côte à côte. Les segments alignés peuvent être parallèles ou antiparallèles—c’est-à—dire que les n-bornes peuvent faire face dans la même direction sur des chaînes adjacentes ou dans des directions différentes-et sont connectés par liaison hydrogène interchaine (Figure \(\PageIndex{3}\))., La feuille β-plissée est particulièrement importante dans les protéines structurelles, telles que la fibroïne de soie. On le voit également dans des portions de nombreuses enzymes, telles que la carboxypeptidase A et le lysozyme.
La structure tertiaire fait référence à la forme tridimensionnelle unique de la protéine dans son ensemble, qui résulte du pliage et de la flexion de l’épine dorsale protéique. La structure tertiaire est intimement liée au bon fonctionnement biochimique de la protéine. La Figure \(\PageIndex{4}\) montre une représentation de la structure tridimensionnelle de l’insuline.
quatre grands types d’interactions attractives déterminent la forme et la stabilité de la structure tertiaire des protéines. Vous en avez étudié plusieurs auparavant.
- des liaisons Ioniques. Les liaisons ioniques résultent d’attractions électrostatiques entre les chaînes latérales chargées positivement et négativement des acides aminés., Par exemple, l’attraction mutuelle entre un ion carboxylate d’acide aspartique et un ion lysine ammonium aide à maintenir une zone repliée particulière d’une protéine (partie (a) de la Figure \(\PageIndex{5}\)).
- liaison hydrogène. La liaison hydrogène se forme entre une très électronégatif atome d’oxygène ou un atome d’azote et un atome d’hydrogène lié à un autre atome d’oxygène ou un atome d’azote, tels que ceux trouvés dans les acides aminés des chaînes latérales., La liaison hydrogène (ainsi que les attractions ioniques) est extrêmement importante dans les interactions intra et intermoléculaires des protéines (partie (b) de la Figure \(\PageIndex{5}\)).
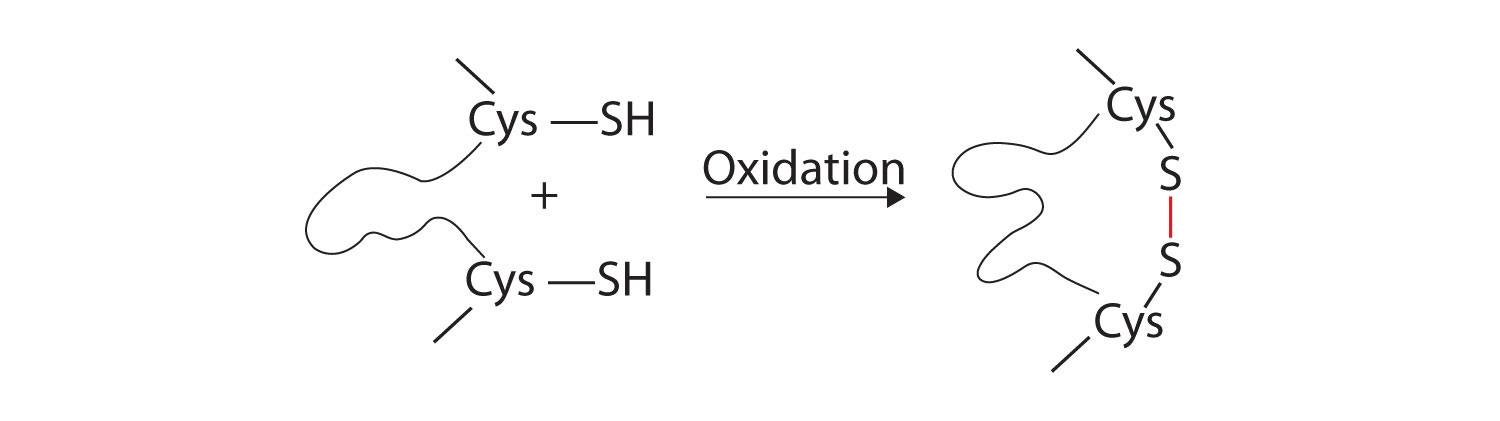
- liaisons disulfures. Deux unités d’acides aminés de cystéine peuvent être rapprochées lorsque la molécule de protéine se plie. L’oxydation et la liaison ultérieures des atomes de soufre dans les groupes sulfhydryle (SH) hautement réactifs conduisent à la formation de cystine (partie (c) de la Figure \(\PageIndex{5}\))., Des liaisons disulfures d’intrachaïne se trouvent dans de nombreuses protéines, y compris l’insuline (barres jaunes sur la Figure \(\PageIndex{1}\)) et ont un fort effet stabilisant sur la structure tertiaire.
- les forces de Dispersion. Les forces de Dispersion se produisent lorsqu’un atome normalement non polaire devient momentanément polaire en raison d’une distribution inégale des électrons, conduisant à un dipôle instantané qui induit un déplacement des électrons dans un atome non polaire voisin., Les forces de Dispersion sont faibles mais peuvent être importantes lorsque d’autres types d’interactions sont manquants ou minimes (partie (d) De La Figure \(\PageIndex{5}\)). C’est le cas de la fibroïne, la protéine majeure de la soie, dans laquelle une forte proportion d’acides aminés dans la protéine ont des chaînes latérales non polaires. Le terme interaction hydrophobe est souvent utilisé à mauvais escient comme synonyme de forces de dispersion. Les interactions hydrophobes surviennent parce que les molécules d’eau se lient à l’hydrogène avec d’autres molécules d’eau (ou des groupes dans des protéines capables de se lier à l’hydrogène)., Parce que les groupes non polaires ne peuvent pas s’engager dans la liaison hydrogène, la protéine se plie de telle sorte que ces groupes sont enterrés dans la partie intérieure de la structure protéique, minimisant leur contact avec l’eau.
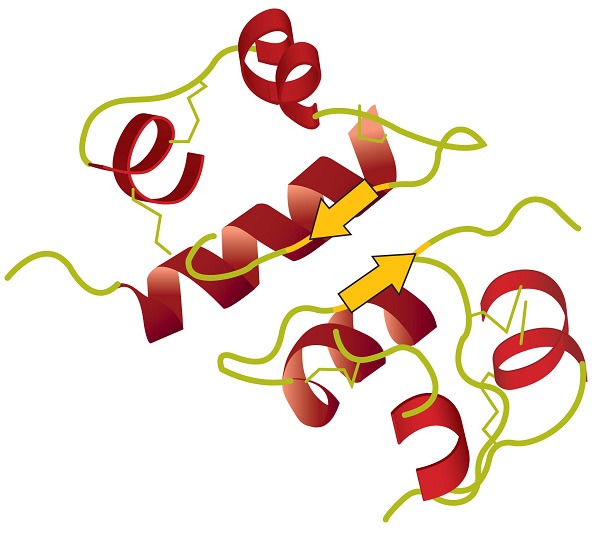
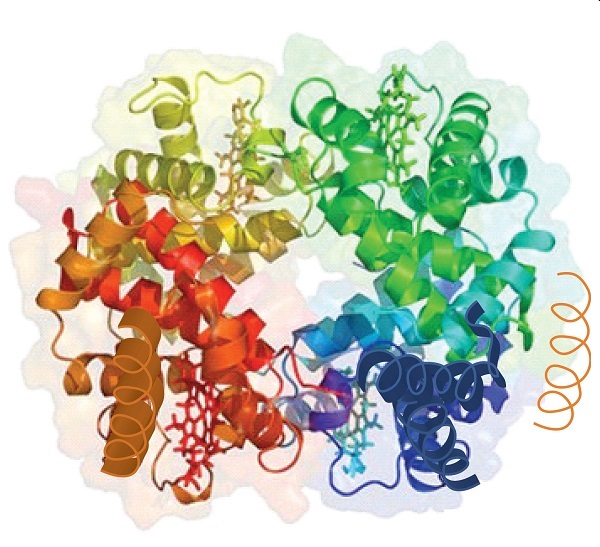
Quand une protéine contient plus d’une chaîne polypeptidique, chaque chaîne est appelé un sous-unité. L’agencement de plusieurs sous-unités représente un quatrième niveau de structure, la structure quaternaire d’une protéine. L’hémoglobine, avec quatre chaînes polypeptidiques ou sous-unités, est l’exemple le plus fréquemment cité d’une protéine ayant une structure quaternaire (Figure \(\PageIndex{6}\))., La structure quaternaire d’une protéine est produite et stabilisée par les mêmes types d’interactions qui produisent et maintiennent la structure tertiaire. Une représentation schématique des quatre niveaux de structure protéique est dans la Figure \(\PageIndex{7}\).
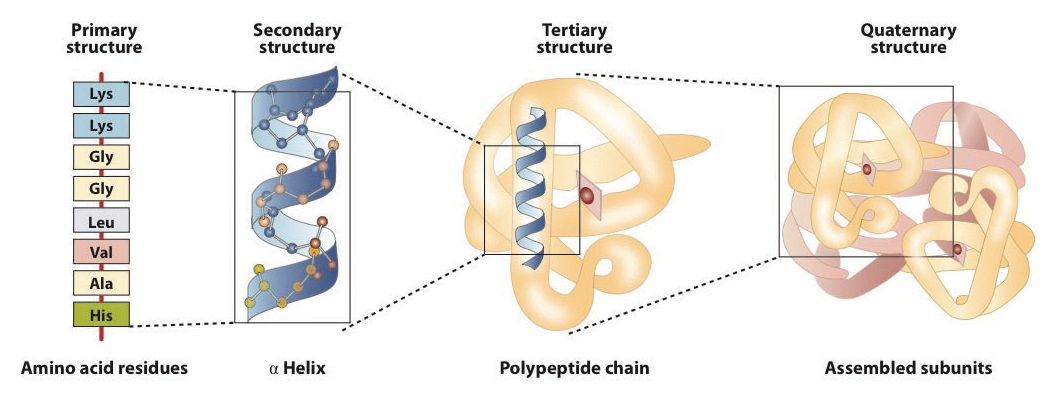
La structure primaire est constitué de l’acide aminé spécifique de la séquence. La chaîne peptidique résultante peut se tordre en une hélice α, Qui est un type de structure secondaire. Ce segment hélicoïdal est incorporé dans la structure tertiaire de la chaîne polypeptidique pliée., La chaîne polypeptidique unique est une sous-unité qui constitue la structure quaternaire d’une protéine, telle que l’hémoglobine qui possède quatre chaînes polypeptidiques.