l’état d’oxydation d’un atome est la charge de cet atome après approximation ionique de ses liaisons hétéronucléaires. Le nombre d’oxydation est synonyme de l’état d’oxydation. Déterminer les nombres d’oxydation à partir de la structure de Lewis (Figure 1a) est encore plus facile que de le déduire de la Formule moléculaire (Figure 1b). Le nombre d’oxydation de chaque atome peut être calculé en soustrayant la somme des paires isolées et des électrons qu’il gagne des liaisons du nombre d’électrons de valence., Les liaisons entre atomes du même élément (liaisons homonucléaires) sont toujours divisées également.
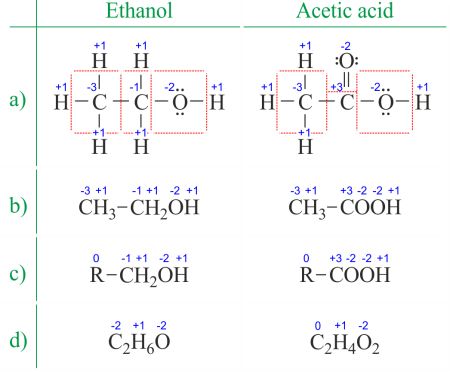
lorsqu’il s’agit de composés organiques et de formules comportant plusieurs atomes d’un même élément, il est plus facile de travailler avec des formules moléculaires et des nombres d’oxydation moyens (Figure 1d). Les composés organiques peuvent être écrits de telle sorte que tout ce qui ne change pas avant la première liaison C-C soit remplacé par l’abréviation R (Figure 1c). Contrairement aux radicaux dans les molécules organiques, R ne peut pas être de l’hydrogène. Puisque les électrons entre deux atomes de carbone sont répartis uniformément, le groupe R ne change pas le nombre d’oxydation de l’atome de carbone auquel il est attaché., Vous trouverez des exemples d’utilisation sur la page diviser la réaction redox en deux demi-réactions.
règles d’attribution des nombres d’oxydation
- Le nombre d’oxydation d’un élément libre est toujours 0.
- Le nombre d’oxydation d’un ion monatomique est égal à la charge de l’ion.
- Le fluor dans les composés reçoit toujours un nombre d’oxydation de -1.
- Les métaux alcalins (groupe I) ont toujours un nombre d’oxydation de +1.
- Les métaux alcalino-terreux (groupe II) se voient toujours attribuer un nombre d’oxydation de +2.,
- L’oxygène a presque toujours un nombre d’oxydation de -2, sauf dans les peroxydes (H2O2) où il est de -1 et dans les composés avec du fluor (OF2) où il est de +2.
- l’Hydrogène a un nombre d’oxydation de +1 lorsqu’il est combiné avec des non-métaux, mais il a un nombre d’oxydation de -1 lorsqu’il est combiné avec des métaux.
- La somme algébrique des nombres d’oxydation des éléments d’un composé est égale à zéro.
- La somme algébrique des états d’oxydation de l’ion est égale à la charge de l’ion.