Les Enzymes sont des molécules organiques spécifiques présentes dans les systèmes biologiques qui permettent à la vie cellulaire d’exister et de fonctionner à la température de la terre. La plupart des réactions chimiques vitales ne peuvent se produire qu’au-dessus de 90°C ou 200°F en l’absence d’enzymes. Les Enzymes sont appelées catalyseurs biologiques macromoléculaires. Ils permettent l’existence de réactions qui ne se produiraient pas autrement dans de nombreuses conditions ayant à voir avec la température, le pH et les conditions atmosphériques dans le corps humain., Les processus métaboliques dans les cellules nécessitent des catalyseurs enzymatiques afin de se produire à des vitesses assez rapides pour soutenir la vie. Les Enzymes sont connues pour catalyser plus de 5 000 types de réactions biochimiques. L’étude de ce sujet complexe s’appelle l’enzymologie. les Enzymes accélèrent la vitesse de réaction chimique de nombreuses manières, abaissant l’énergie d’activation. L’énergie d’Activation est l’énergie qui doit être disponible pour un système chimique ou nucléaire avec des réactifs potentiels pour produire une réaction ou un produit. Les Enzymes réagissent avec d’autres substances, soit pour les séparer, soit pour les assembler., Ils ne modifient pas la position de l’équilibre chimique de la réaction.
les Enzymes accélèrent la vitesse de réaction chimique de nombreuses manières, abaissant l’énergie d’activation. L’énergie d’Activation est l’énergie qui doit être disponible pour un système chimique ou nucléaire avec des réactifs potentiels pour produire une réaction ou un produit. Les Enzymes réagissent avec d’autres substances, soit pour les séparer, soit pour les assembler., Ils ne modifient pas la position de l’équilibre chimique de la réaction.
lors de la présence d’une enzyme, la réaction se déplace dans la même direction que sans l’enzyme, cependant la présence de l’enzyme accélère le processus.
la Fonction et la Nature des Enzymes
les Enzymes sont responsables de:
1. Transduction du Signal et régulation cellulaire souvent par kinases et phosphatases.
2. Générer un mouvement avec de la myosine (protéine musculaire) hydrolysant L’ATP pour générer une contraction musculaire.
3. Transport de marchandises autour de la cellule dans le cadre du cytosquelette.
4., Digestion, métabolisme, respiration
5. Les enzymes digestives telles que les amylases et la protéase décomposent les grosses molécules d’amidons ou de protéines en plus petites pour une bonne absorption dans les intestins.
6. L’Hormone de la production.
7. Absorption et transport des nutriments.
8. Réparation cellulaire et division.
9. Désintoxication
10. Maladie: les virus peuvent contenir des enzymes pour infecter les cellules, c’est-à-dire l’intégrase du VIH et la transcriptase inverse.
Enzymes
1. Stabiliser l’état de transition: A., Créer un environnement avec une distribution de charge complémentaire à celle de l’état de transition pour abaisser son énergie.
2. Fournir une voie de réaction alternative: A. réagit Temporairement avec le substrat, formant un intermédiaire covalent pour fournir un État de transition énergétique inférieur.
3. Déstabilise l’état fondamental du substrat: A. déformer les soustractions liées en leur forme d’état de transition pour réduire l’énergie nécessaire pour atteindre l’état de transition. B. Orienter les substrats dans un agencement productif pour réduire le changement d’entropie de réaction (thermodynamique).,
Les Enzymes réagissent essentiellement avec d’autres substances, soit pour les séparer, soit pour les assembler.
Les Enzymes sont divisées comme suit:
1. Simple: contient uniquement la partie protéique (par exemple, des hydrolases comme la pepsine, la trypsine ou la ribonucléase).
2. Complexe: les protéines peuvent être jointes à une partie non protéique, appelée groupes prothétiques. La partie protéique s’appelle l’apoenzyme. La partie non protéique est appelée cofacteur. Ensemble, l’apoenzyme et le cofacteur forment une molécule d’enzyme biologiquement active-l’holoenzyme.
Cofacteurs:
un., Ion métallique: aide l’enzyme à positionner la molécule de substrat dans le site actif. Appelés activateurs, les métaux associés peuvent comprendre le cuivre, le cobalt, le zinc, le magnésium, le molybdène et le manganèse.
B. molécule organique: souvent des vitamines telles que la riboflavine, les vitamines B et la vitamine C.
C. Coenzymes: une molécule organique non protéique qui se lie librement à la molécule d’apoenzyme, peut donc s’en détacher, C’est-à-dire NAD+ (Nicotinamide adénine dinucléotide) et NADP+ (nicotinamide adénine dinucléotide phosphate). NAD + et NADP+ sont des porteurs d’électrons dans la respiration cellulaire., NADP+ est créé dans la réaction anabolique, ou réaction qui construisent de grandes molécules à partir de petites molécules.
D. groupe prothétique: molécule organique non protéique qui se lie étroitement à la molécule d’apoenzyme, c’est-à-dire hème, FAD (flavine adénine dinucléotide)
un substrat
Les molécules sur lesquelles les enzymes réagissent s’appellent un substrat. L’enzyme reste intacte et n’est pas consommée lors de réactions chimiques. Elles ne modifient la stabilité d’une réaction. Au lieu de cela, ils soutiennent la progression d’une réaction en maintenant l’équilibre., La majorité des enzymes sont des protéines constituées d’acides aminés, les blocs de construction de base dans le corps.
Il existe des exceptions avec certains types de molécules D’ARN appelées ribozymes. Les molécules d’acides aminés sont reliées par des liaisons appelées liaisons peptidiques qui forment des protéines.
Les Enzymes sont constituées d’un nombre différent de chaînes peptidiques et sont appelées complexes multienzymes. Un exemple de complexes multienzymatiques serait l’acide gras synthase, une enzyme catalysant la synthèse d’acides gras supérieurs dans les cellules., Chimiquement, les petits groupes d’acides aminés liés sont appelés molécules polymères ou appelés en biochimie poly peptides.
il faut 30 acides aminés pour former une chaîne assez longue qui permet aux molécules d’influencer sa propre forme en devenant une protéine. Si une chaîne ou plusieurs chaînes, il contient plusieurs parties appelées domaines. Les protéines remplissent de nombreuses fonctions biochimiques, y compris des caractéristiques structurelles anatomiques dans les organismes, les porteurs de nutriments, les antigènes et les hormones.,
Le complexe Enzyme – substrat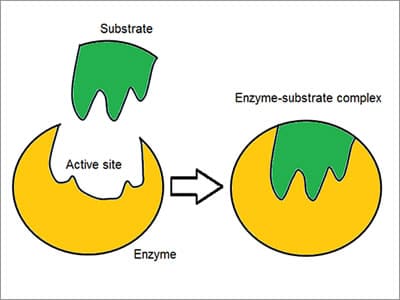 inventé comme un modèle « Lock and key”, les enzymes réagissent avec d’autres substances pour les démonter ou les assembler. Il existe une spécificité élevée des enzymes démontrée par la manière dont elles s’associent ou se lient au substrat: la molécule réactive. Chimiosélective, chaque molécule enzymatique possède un site actif à sa surface. La molécule réactive est attirée et moulée dans l’indentation qui forme le site actif.,
inventé comme un modèle « Lock and key”, les enzymes réagissent avec d’autres substances pour les démonter ou les assembler. Il existe une spécificité élevée des enzymes démontrée par la manière dont elles s’associent ou se lient au substrat: la molécule réactive. Chimiosélective, chaque molécule enzymatique possède un site actif à sa surface. La molécule réactive est attirée et moulée dans l’indentation qui forme le site actif.,
La spécificité est obtenue en liant des poches avec des caractéristiques complémentaires, de forme, de charge et hydrophiles/hydrophobes aux substrats. Le site actif continue de changer jusqu’à ce que le substrat soit complètement lié, ce qui donne une forme finale.
cela dit, les enzymes sont des structures flexibles et le site actif est continuellement remodelé par interaction avec le substrat lorsqu’il interagit avec l’enzyme.
contrôle de l’activité enzymatique
Les Enzymes guident et régulent le métabolisme d’une cellule et sont soigneusement contrôlées., Le mécanisme d’action des enzymes implique des molécules régulatrices qui peuvent soit augmenter (activateur), soit inhiber (inhibiteurs) l’activité d’une enzyme. Un inhibiteur enzymatique est une molécule qui se lie à une enzyme et bloque la liaison d’un substrat, diminuant son activité. Si une enzyme produit trop d’une substance dans un organisme, cette substance commence à agir comme un inhibiteur de l’enzyme au début de la voie sous forme de rétroaction négative, ralentissant la réaction. Les médicaments peuvent être des inhibiteurs enzymatiques., Par exemple, le blocage de l’activité d’une enzyme peut tuer un agent pathogène ou corriger un déséquilibre métabolique.
le contrôle de l’activité enzymatique est essentiel pour l’homéostasie dans le corps. Lorsqu’il y a défaillance d’une enzyme telle qu’une mutation, sur ou sous production, ou la suppression, cela peut conduire à une maladie génétique. Dans certains cas, elle peut être fatale. Par exemple, l’insuffisance pancréatique est une condition qui survient lorsque le pancréas ne produit pas assez d’une enzyme nécessaire à la digestion des aliments dans l’intestin grêle.,
Tableau 1-facteurs affectant ou contrôlant l’activité enzymatique 
modulation de la température
l’activité catalytique des enzymes nécessite une température optimale dans le corps. Les enzymes humaines ont une activité maximale à 37oC. Les Enzymes peuvent devenir vulnérables aux changements de température. En raison de leur nature protéique, l’application d’une température élevée entre 55 et 60 O C provoque une dénaturation des protéines, produisant un changement conformationnel et une destruction des protéines. Ce changement provoque une chute ou un arrêt complet de la réaction., De plus, les basses températures peuvent ralentir les réactions, réduisant l’activité des enzymes.
pH
Les Enzymes sont sensibles au changement de pH. comme dans les changements de température, les extrêmes de faible et élevé conduisent à nouveau à la dénaturation des molécules. La Concentration de H + affecte l’ionisation des groupes acides et basiques
sources enzymatiques
1. Enzymes métaboliques: régule les organes, les tissus et le sang. Aidez à créer de nouvelles cellules, à réparer les cellules endommagées existantes et à déplacer les nutriments là où votre corps en a le plus besoin.
2. Enzymes digestives: décompose les aliments. Sous-types-amylase, lipase,protéase
3., Aliments crus: soutient le système immunitaire, la réparation cellulaire.
Il existe six grandes classes d’enzymes ayant une fonction spécifique. Il y a aussi des sous-groupes.
Tableau 2-types D’enzymes 
sous-groupes enzymatiques:
Les Hydrolases sont des enzymes qui séparent l’eau, séparant les parties des molécules.
Les Hydrogénases sont des enzymes qui ajoutent des atomes d’hydrogène à d’autres molécules; la 5 alpha réductase en est un exemple.
Les oxydases catalysent les oxydations en ajoutant de l’oxygène ou des électrons aux molécules ou aux atomes.,
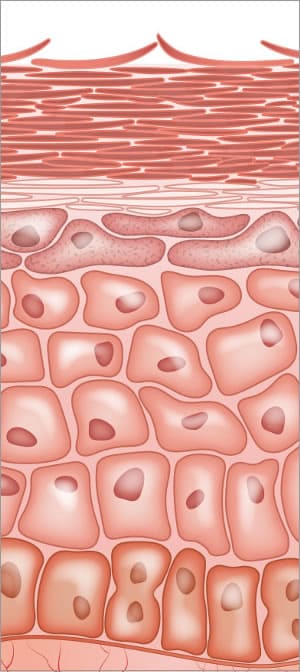 Enzymes dans la peau; construction de la barrière cutanée et processus final de desquamation
Enzymes dans la peau; construction de la barrière cutanée et processus final de desquamation
l’ensemble du processus de différenciation épidermique dépend de l’activité enzymatique. Les hydrolases lipidiques sont responsables de la conversion des lipides en céramides et en acides gras libres. Les Enzymes sont impliquées dans la modification du profilaggrine et le traitement protéolytique dans l’épiderme. Les phases de transition saines de l’ensemble du processus de construction de la couche cornée sont vitales et dépendent des enzymes.,
Les enzymes protéases sont essentielles au processus normal de desquamation dans les cellules de la couche cornée (SC). Les Desmosomes sont importants pour une forte adhérence de cellule à cellule. Le processus de desquamation implique la protéolyse des structures adhésives intercellulaires créées dans les structures desmosomes. Il existe des enzymes protéases spécifiques dans la couche cornée appelées enzyme tryptique et enzyme chymotryptique impliquées dans la dégradation des cornéodesmosomes. Deux protéines présentes dans les desmosomes sont la desmogléine et la desmocolline, situées aux interconnexions dans les cellules.,
l’enzyme chymotryptique de la couche cornée est produite comme précurseur inactif sans activité protéolytique. Par conséquent, il y a une exigence d’une enzyme activante qui implique une enzyme avec un substrat de type trypsine. Différentes protéases attaquent les différents sites d’acides aminés sur les protéines de la desmogléine et de la desmocolline. Lorsque les liaisons sont affaiblies, elles se brisent, permettant aux cellules de s’écailler.
le processus de desquamation nécessite de l’eau de l’intérieur de l’épiderme et un pH normal. l’orchestration de toutes les activités biologiques est complexe et doit fonctionner en synergie les unes avec les autres.
1., Pugliese, Peter T. MD. (2005) Annexe A. Enzymes et activité enzymatique. Soins De La Peau Professionnels Avancés-Édition Médicale. p 390-392 L’Agent topique, LLC, Burnsville, PA
2. Enzyme. Wikipedia.org extrait de https://en.wikipedia.org/wiki/Enzyme
3. IBID-Pugliese-Ref 1
4. IBID-Lavrikova p.
5. Sous-Chapitre Auteur: Petra Lavrikova. Chapitre 6. Enzymes. Fonction des cellules et du corps humain. Extrait de http://fblt.cz/en/skripta/ii-premena-latek-a-energie-v-bunce/6-enzymy/
6. IBID-Lavrikova p.
7. IBID-Pugliese
8. IBID-voir Réf. 2
9. Régulation Enzymatique., Biologie énergie et Enzymes extraites de https://www.khanacademy.org/science/biology/energy-and-enzymes/enzyme-regulation/a/enzyme-regulation
10. Inhibiteur enzymatique extrait de https://en.wikipedia.org/wiki/Enzyme_inhibiteur
11. Insuffisance Pancréatique. Centre des maladies digestives, Université Médicale de Caroline du Sud. Extrait de http://ddc.musc.edu/public/diseases/pancreas-biliary-system/pancreatic-insufficiency.html
12. Régulation Enzymatique. Biologie énergie et Enzymes. Khan Academy p. 2 Extrait de https://www.khanacademy.org/science/biology/energy-and-enzymes/enzyme-regulation/a/enzyme-regulation
13. IBID – Lavrikova, pg. 5
14. Snyder, Kimberly. (Décembre 06 2017) Comment les Enzymes affectent la beauté et la santé. Extrait de https://www.huffingtonpost.com/kimberly-snyder/enzymes-beauty-health_b_1201847.html
15. IBID-Pugliese pg 391
16., IBID-Lavrikova p 7
17. Preland, R., Rothnagel, J., Laurent, O. (2006), Chapitre 9, ex profilaggrine et le fil S100 de la Famille des Protéines Liant le Calcium. Barrière cutanée, Elias & Feingold.
18. Ekholm, E., Brattasnd, M., Egelrud, T. (Janv. 2000) Enzyme tryptique de la couche cornée dans L’épiderme Normal: un chaînon manquant dans le processus de Desquamation? Journal of Investigative Dermatology, Vol 114, numéro 1, PP 56-63 extrait de https://www.sciencedirect.com/science/article/pii/S0022202X15407316
19. IBID-Pugliese-Ref 1
20. IBID-Ref 17, p. 56