objetivos de aprendizaje
al final de esta sección, podrá:
- Definir compuestos iónicos y moleculares (covalentes)
- predecir el tipo de compuesto formado a partir de elementos en función de su ubicación dentro de la Tabla periódica
- Reacciones químicas ordinarias, el núcleo de cada átomo (y por lo tanto la identidad del elemento) permanece sin cambios., Los electrones, sin embargo, pueden ser añadidos a los átomos por transferencia de otros átomos, perdidos por transferencia a otros átomos, o compartidos con otros átomos. La transferencia y el intercambio de electrones entre átomos gobiernan la química de los elementos. Durante la formación de algunos compuestos, los átomos ganan o pierden electrones, y forman partículas cargadas eléctricamente llamadas iones (Figura 1).
Puede usar la Tabla periódica para predecir si un átomo formará un anión o un catión, y a menudo puede predecir la carga del ion resultante., Los átomos de muchos metales del grupo principal pierden suficientes electrones para dejarlos con el mismo número de electrones que un átomo del gas noble precedente. Para ilustrar, un átomo de un metal alcalino (Grupo 1) pierde un electrón y forma un catión con una carga de 1+; un metal alcalinotérreo (Grupo 2) pierde dos electrones y forma un catión con una carga de 2+, y así sucesivamente. Por ejemplo, un átomo de calcio neutro, con 20 protones y 20 electrones, pierde fácilmente dos electrones. Esto resulta en un catión con 20 protones, 18 electrones y una carga de 2+., Tiene el mismo número de electrones que los átomos del gas noble precedente, argón, y se simboliza Ca2+. El nombre de un ion metálico es el mismo que el nombre del átomo metálico del que se forma, por lo que Ca2+ se llama un ion de calcio.
cuando los átomos de elementos no metálicos forman iones, generalmente ganan suficientes electrones para darles el mismo número de electrones que un átomo del siguiente gas noble en la Tabla periódica. Los átomos del grupo 17 ganan un electrón y forman aniones con una carga 1; los átomos del grupo 16 ganan dos electrones y forman iones con una carga 2, y así sucesivamente., Por ejemplo, el átomo de bromo neutro, con 35 protones y 35 electrones, puede obtener un electrón para proporcionarle 36 electrones. Esto resulta en un anión con 35 protones, 36 electrones y una carga 1. Tiene el mismo número de electrones que los átomos del siguiente gas noble, el criptón, y está simbolizado como Br -. (Una discusión de la teoría que apoya el estado Favorecido de los números de electrones de gases nobles reflejados en estas reglas predictivas para la formación de iones se proporciona en un capítulo posterior de este texto.)
Nótese la utilidad de la Tabla periódica para predecir la probable formación y carga de iones (Figura 2)., Moviéndose del extremo izquierdo a la derecha en la Tabla periódica, los elementos del grupo principal tienden a formar cationes con una carga igual al número del grupo. Es decir, los elementos del Grupo 1 forman 1 + iones; los elementos del Grupo 2 forman 2 + iones, y así sucesivamente. Moviéndose del extremo derecho a la izquierda en la Tabla periódica, los elementos a menudo forman aniones con una carga negativa igual al número de grupos movidos a la izquierda de los gases nobles. Por ejemplo, los elementos del grupo 17 (un grupo a la izquierda de los gases nobles) forman 1− iones; los elementos del grupo 16 (dos grupos a la izquierda) forman 2− iones, y así sucesivamente., Esta tendencia se puede utilizar como guía en muchos casos, pero su valor predictivo disminuye al moverse hacia el Centro de la Tabla periódica. De hecho, los metales de transición y algunos otros metales a menudo presentan cargas variables que no son predecibles por su ubicación en la tabla. Por ejemplo, el cobre puede formar iones con una carga de 1+ o 2+, y el hierro puede formar iones con una carga de 2+ o 3+.
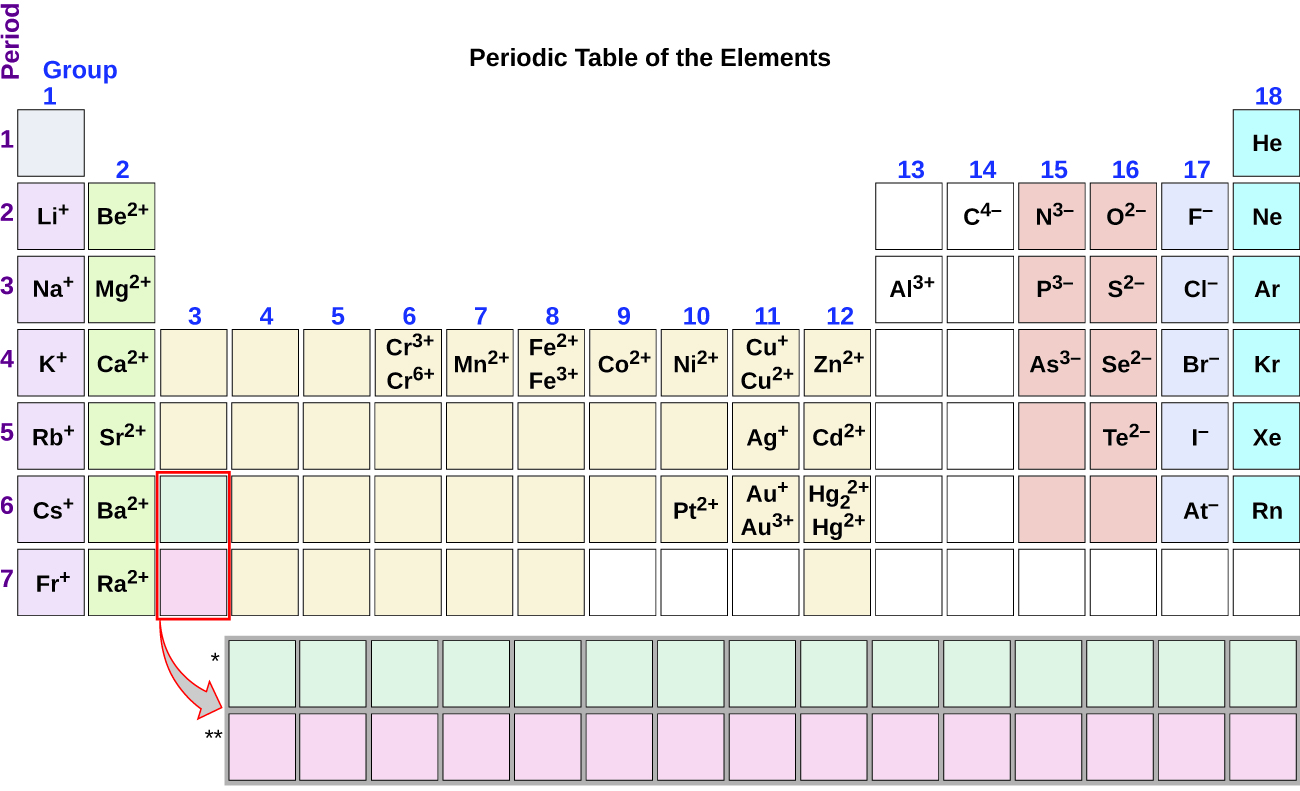
Figura 2. Algunos elementos exhiben un patrón regular de carga iónica cuando forman iones., ejemplo 1
composición de iones
un ion encontrado en algunos compuestos utilizados como antitranspirantes contiene 13 protones y 10 electrones. ¿Cuál es su símbolo?solución
debido a que el número de protones permanece sin cambios cuando un átomo forma un ion, el número atómico del elemento debe ser 13. Saber esto nos permite usar la Tabla periódica para identificar el elemento como Al (aluminio). El átomo Al ha perdido tres electrones y por lo tanto tiene tres cargas positivas más (13) que los electrones (10). Este es el catión de aluminio, Al3+.,comprueba tu aprendizaje
da el símbolo y el nombre del ion con 34 protones y 36 electrones.Respuesta:
Se2−, el seleniuro de iones
Ejemplo 2
la Formación de Iones
Magnesio y nitrógeno reaccionan para formar un compuesto iónico. Predecir qué forma un anión, qué forma un catión, y las cargas de cada ion. Escribe el símbolo para cada ion y nómbralos.solución
La posición del magnesio en la Tabla periódica (Grupo 2) nos dice que es un metal. Los metales forman iones positivos (cationes)., Un átomo de magnesio debe perder dos electrones para tener el mismo número de electrones que un átomo del gas noble anterior, el neón. Por lo tanto, un átomo de magnesio formará un catión con dos electrones menos que los protones y una carga de 2+. El símbolo para el ion es Mg2+, y se llama un ion de magnesio.la posición del nitrógeno en la Tabla periódica (grupo 15) revela que es un no metal. Los no metálicos forman iones negativos (aniones). Un átomo de nitrógeno debe ganar tres electrones para tener el mismo número de electrones que un átomo del siguiente gas noble, el neón., Así, un átomo de nitrógeno formará un anión con tres electrones más que los protones y una carga de 3 -. El símbolo del ion es N3 -, y se llama ion nitruro.
Compruebe su aprendizaje
El aluminio y el carbono reaccionan para formar un compuesto iónico. Predecir qué forma un anión, qué forma un catión, y las cargas de cada ion. Escribe el símbolo para cada ion y nómbralos.respuesta:
Al formará un catión con una carga de 3+: Al3+, un ion de aluminio. El carbono formará un anión con una carga de 4 -: C4 -, un ion de carburo.,
los iones que hemos discutido hasta ahora se llaman iones monatómicos, es decir, son iones formados de un solo átomo. También encontramos muchos iones poliatómicos. Estos iones, que actúan como unidades discretas, son moléculas cargadas eléctricamente (un grupo de átomos unidos con una carga total). Algunos de los iones poliatómicos más importantes se enumeran en la Tabla 6. Los oxianiones son iones poliatómicos que contienen uno o más átomos de oxígeno. En este punto de su estudio de la química, debe memorizar los nombres, fórmulas y cargas de los iones poliatómicos más comunes., Debido a que los usarás repetidamente, pronto se volverán familiares.
tenga en cuenta que hay un sistema para nombrar algunos iones poliatómicos; -ate y-IT son sufijos que designan iones poliatómicos que contienen más o menos átomos de oxígeno. Per – (abreviatura de «hiper») y hypo – (que significa «debajo») son prefijos que significan más átomos de oxígeno que-ate y menos átomos de oxígeno que-it, respectivamente. Por ejemplo, el perclorato es ClO4 -, el clorato es ClO3−, el clorito es ClO2−y el hipoclorito es ClO -., Desafortunadamente, el número de átomos de oxígeno correspondiente a un sufijo o prefijo dado no es consistente; por ejemplo, el nitrato es NO3− mientras que el sulfato es SO42−. Esto se tratará con más detalle en el próximo módulo sobre Nomenclatura.
la naturaleza de las fuerzas de atracción que mantienen unidos átomos o iones dentro de un compuesto es la base para clasificar el enlace químico. Cuando se transfieren electrones y se forman iones, se producen enlaces iónicos., Los enlaces iónicos son fuerzas electrostáticas de atracción, es decir, las fuerzas de atracción experimentadas entre objetos de carga eléctrica opuesta (en este caso, cationes y aniones). Cuando los electrones son «compartidos» y las moléculas se forman, los enlaces covalentes resultan. Los enlaces covalentes son las fuerzas de atracción entre los núcleos cargados positivamente de los átomos enlazados y uno o más pares de electrones que se encuentran entre los átomos. Los compuestos se clasifican como iónicos o moleculares (covalentes) sobre la base de los enlaces presentes en ellos.,
Cuando un elemento compuesto de átomos que pierden electrones fácilmente (un metal) reacciona con un elemento compuesto de átomos que ganan electrones fácilmente (un no metal), generalmente ocurre una transferencia de electrones, produciendo iones. El compuesto formado por esta transferencia es estabilizado por las atracciones electrostáticas (enlaces iónicos) entre los iones de carga opuesta presentes en el compuesto., Por ejemplo, cuando cada átomo de sodio en una muestra de metal de sodio (Grupo 1) da un electrón para formar un catión de sodio, Na+, y cada átomo de cloro en una muestra de gas de cloro (grupo 17) acepta un electrón para formar un anión de cloruro, Cl−, el compuesto resultante, NaCl, está compuesto de iones de sodio e iones de cloruro en la proporción de un ion Na+ por cada Cl− ion. De manera similar, cada átomo de calcio (Grupo 2) puede dar dos electrones y transferir uno a cada uno de dos átomos de cloro para formar CaCl2, que está compuesto de iones Ca2+ y CL− en la proporción de un ion Ca2+ a dos iones Cl−.,
un compuesto que contiene iones y se mantiene unido por enlaces iónicos se llama un compuesto iónico. La Tabla periódica puede ayudarnos a reconocer muchos de los compuestos que son iónicos: cuando un metal se combina con uno o más no metales, el compuesto suele ser iónico. Esta guía funciona bien para predecir la formación de compuestos iónicos para la mayoría de los compuestos típicamente encontrados en un curso introductorio de química. Sin embargo, no siempre es cierto (por ejemplo, el cloruro de aluminio, AlCl3, no es iónico).
a menudo se pueden reconocer compuestos iónicos debido a sus propiedades., Los compuestos iónicos son sólidos que típicamente se funden a altas temperaturas y hierven a temperaturas aún más altas. Por ejemplo, el cloruro de sodio se funde a 801 °C y hierve a 1413 °C. (Como comparación, el compuesto molecular de agua se funde a 0 °C y hierve a 100 °C.) en forma sólida, un compuesto iónico no es eléctricamente conductor porque sus iones son incapaces de fluir («electricidad» es el flujo de partículas cargadas). Cuando está fundido, sin embargo, puede conducir electricidad porque sus iones son capaces de moverse libremente a través del líquido (Figura 3).,

Figura 3. El cloruro de sodio se funde a 801 ° C y conduce la electricidad cuando se funde. (crédito: modificación del trabajo por Mark Blaser y Matt Evans) 
vea este video para ver una mezcla de sales fundirse y conducir electricidad.
En cada compuesto iónico, el número total de cargas positivas de los cationes es igual al número total de cargas negativas de los aniones., Por lo tanto, los compuestos iónicos son eléctricamente neutros en general, a pesar de que contienen iones positivos y negativos. Podemos usar esta observación para ayudarnos a escribir la fórmula de un compuesto iónico. La fórmula de un compuesto iónico debe tener una relación de iones tal que el número de cargas positivas y negativas sean iguales.
Ejemplo 3
predicción de la fórmula de un compuesto iónico
El zafiro de la piedra preciosa (figura 4) es principalmente un compuesto de aluminio y oxígeno que contiene cationes de aluminio, AL3+, y aniones de oxígeno, O2−. ¿Cuál es la fórmula de este compuesto?,
Figura 4. Aunque el óxido de aluminio puro es incoloro, las trazas de hierro y titanio le dan al zafiro azul su color característico. (crédito: modificación del trabajo por Stanislav Doronenko) Solution
debido a que el compuesto iónico debe ser eléctricamente neutro, debe tener el mismo número de cargas positivas y negativas., Dos iones de aluminio, cada uno con una carga de 3+, nos daría seis cargas positivas, y tres iones de óxido, cada uno con una carga de 2 -, nos daría seis cargas negativas. La fórmula sería Al2O3.Compruebe su aprendizaje
predecir la fórmula del compuesto iónico formado entre el catión de sodio, Na+, y el anión sulfuro, S2−.Respuesta:
Na2S
Muchos de los compuestos iónicos contienen iones poliatómicos (Tabla 6) como el de cationes, aniones, o ambos., Al igual que con los compuestos iónicos simples, estos compuestos también deben ser eléctricamente neutros, por lo que sus fórmulas pueden predecirse tratando los iones poliatómicos como unidades discretas. Usamos paréntesis en una fórmula para indicar un grupo de átomos que se comportan como una unidad. Por ejemplo, la fórmula para el fosfato de calcio, uno de los minerales en nuestros huesos, es Ca3(PO4)2. Esta fórmula indica que hay tres iones de calcio (Ca2+) por cada dos grupos de fosfato (PO43−). Los grupos PO43-son unidades discretas, cada una compuesta por un átomo de fósforo y cuatro átomos de oxígeno, y con una carga total de 3 -., El compuesto es eléctricamente neutro, y su fórmula muestra una cuenta total de tres átomos de Ca, dos de P y ocho de O.
Ejemplo 4
predecir la fórmula de un compuesto con un anión poliatómico
El polvo de hornear contiene dihidrógeno fosfato de calcio, un compuesto iónico compuesto por los iones Ca2+ y H2PO4−. ¿Cuál es la fórmula de este compuesto?solución
Las cargas positivas y negativas deben equilibrarse, y este compuesto iónico debe ser eléctricamente neutro. Por lo tanto, debemos tener dos cargas negativas para equilibrar la carga 2+ del ion de calcio., Esto requiere una relación de un ion Ca2 + a dos iones H2PO4−. Designamos esto encerrando la fórmula para el ion dihidrogenofosfato entre paréntesis y agregando un subíndice 2. La fórmula es Ca (H2PO4)2.Compruebe su aprendizaje
predecir la fórmula del compuesto iónico formado entre el ion litio y el ion peróxido, O22− (sugerencia: utilice la Tabla periódica para predecir el signo y la carga en el ion litio.,)respuesta:
Li2O2
debido a que un compuesto iónico no está compuesto de moléculas individuales y discretas, puede no ser simbolizado correctamente usando una fórmula molecular. En cambio, los compuestos iónicos deben ser simbolizados por una fórmula que indica el número relativo de sus iones constituyentes. Para compuestos que contienen solo iones monatómicos (como NaCl) y para muchos compuestos que contienen iones poliatómicos (como CaSO4), estas fórmulas son solo las fórmulas empíricas introducidas anteriormente en este capítulo., Sin embargo, las fórmulas para algunos compuestos iónicos que contienen iones poliatómicos no son fórmulas empíricas. Por ejemplo, el compuesto iónico oxalato de sodio se compone de iones Na+ y c2o42 combinados en una relación 2: 1, y su fórmula se escribe como Na2C2O4. Los subíndices en esta fórmula no son los números enteros más pequeños posibles, ya que cada uno se puede dividir por 2 para obtener la fórmula empírica, NaCO2. Sin embargo, esta no es la fórmula aceptada para el oxalato de sodio, ya que no representa con precisión el anión poliatómico del compuesto, C2O42−.,
compuestos moleculares
muchos compuestos no contienen iones, sino que consisten únicamente en moléculas discretas y neutras. Estos compuestos moleculares (compuestos covalentes) resultan cuando los átomos comparten, en lugar de transferir (ganar o perder), electrones. La unión covalente es un concepto importante y extenso en química, y se tratará con considerable detalle en un capítulo posterior de este texto. A menudo podemos identificar compuestos moleculares sobre la base de sus propiedades físicas., En condiciones normales, los compuestos moleculares a menudo existen como gases, líquidos de baja ebullición y sólidos de baja fusión, aunque existen muchas excepciones importantes.
mientras que los compuestos iónicos generalmente se forman cuando un metal y un no metal se combinan, los compuestos covalentes generalmente se forman por una combinación de no metales. Por lo tanto, la Tabla periódica puede ayudarnos a reconocer muchos de los compuestos que son covalentes., Si bien podemos usar las posiciones de los elementos de un compuesto en la Tabla periódica para predecir si es iónico o covalente en este punto de nuestro estudio de la química, debe ser consciente de que este es un enfoque muy simplista que no tiene en cuenta una serie de excepciones interesantes. Los tonos de gris existen entre los compuestos iónicos y moleculares, y aprenderás más sobre ellos más adelante.,
ejemplo 5
predecir el tipo de unión en compuestos
predecir si los siguientes compuestos son iónicos o moleculares:(A) KI, el compuesto utilizado como fuente de yodo en la sal de mesa
(B) H2O2, el blanqueador y el peróxido de hidrógeno desinfectante
(c) CHCl3, el cloroformo anestésico
(D) Li2CO3, una fuente de litio en antidepresivos
solución
(a) el potasio (Grupo 1) es un metal, y el yodo (grupo 17) es un no metal; se prevé que el ki sea iónico.,(b) El hidrógeno (Grupo 1) es un no metal, y el oxígeno (grupo 16) es un no metal; se prevé que el H2O2 sea molecular.
(c) el carbono (grupo 14) es un no metal, el hidrógeno (Grupo 1) es un no metal, y el cloro (grupo 17) es un no metal; se prevé que el CHCl3 sea molecular.
(D) El litio (Grupo 1) es un metal, y el carbonato es un ion poliatómico; se predice que Li2CO3 es iónico.,
Verifique su aprendizaje
usando la Tabla periódica, prediga si los siguientes compuestos son iónicos o covalentes:(a) SO2
(B) CaF2
(c) N2H4
(d) Al2(SO4)3
respuesta:
(a) molecular; (b) iónico; (c) molecular; (d)) ionic
conceptos clave y resumen
los metales (particularmente los de los grupos 1 y 2) tienden a perder el número de electrones que los dejaría con el mismo número de electrones que en el gas noble anterior en la tabla periódica. Por este medio, se forma un ion cargado positivamente., De manera similar, los no metálicos (especialmente los de los grupos 16 y 17, y, en menor medida, los del Grupo 15) pueden obtener el número de electrones necesario para proporcionar a los átomos el mismo número de electrones que en el siguiente gas noble en la Tabla periódica. Por lo tanto, los no metálicos tienden a formar iones negativos. Los iones cargados positivamente se llaman cationes, y los iones cargados negativamente se llaman aniones. Los iones pueden ser monatómicos (conteniendo solo un átomo) o poliatómicos (conteniendo más de un átomo).
los Compuestos que contienen iones se denominan compuestos iónicos., Los compuestos iónicos generalmente se forman a partir de metales y no metales. Los compuestos que no contienen iones, sino que consisten en átomos unidos estrechamente entre sí en moléculas (grupos de átomos no cargados que se comportan como una sola unidad), se denominan compuestos covalentes. Los compuestos covalentes generalmente se forman a partir de dos no metales.,lar compuesto), compuesto de moléculas formadas por átomos de dos o más elementos de enlace iónico fuerzas electrostáticas de atracción entre las cargas opuestas de los iones de un compuesto iónico iónico compuesto compuesto compuesto de cationes y aniones combinados en proporciones, dando un eléctricamente neutro sustancia compuesto molecular (también, compuesto covalente) compuesto de moléculas formadas por átomos de dos o más elementos monoatómicos de iones de iones compuesto de un solo átomo oxianión anión poliatómico compuesto de un átomo central unido a átomos de oxígeno ion poliatómico de iones compuestos de más de un átomo