Gli enzimi sono molecole organiche specifiche presenti nei sistemi biologici che consentono alla vita cellulare di esistere e funzionare a temperature terrestri. La maggior parte delle reazioni chimiche di supporto vitale potrebbe verificarsi solo al di sopra di 90°C o 200°F in assenza di enzimi. Gli enzimi sono indicati come catalizzatori biologici macromolecolari. Permettono l’esistenza di reazioni che non si verificherebbero altrimenti in numerose condizioni che hanno a che fare con temperatura, pH e condizioni atmosferiche all’interno del corpo umano., I processi metabolici all’interno delle cellule richiedono catalizzatori enzimatici per verificarsi a velocità abbastanza veloci da sostenere la vita. Gli enzimi sono noti per catalizzare più di 5.000 tipi di reazione biochimica. Lo studio di questo argomento complesso è chiamato enzimologia.
 Gli enzimi accelerano la velocità di reazione chimica in numerosi modi, riducendo l’energia di attivazione. L’energia di attivazione è l’energia che deve essere disponibile per un sistema chimico o nucleare con potenziali reagenti per produrre una reazione o un prodotto. Gli enzimi reagiscono con altre sostanze, per smontarli o unirli insieme., Non alterano la posizione dell’equilibrio chimico della reazione.
Gli enzimi accelerano la velocità di reazione chimica in numerosi modi, riducendo l’energia di attivazione. L’energia di attivazione è l’energia che deve essere disponibile per un sistema chimico o nucleare con potenziali reagenti per produrre una reazione o un prodotto. Gli enzimi reagiscono con altre sostanze, per smontarli o unirli insieme., Non alterano la posizione dell’equilibrio chimico della reazione.
Durante la presenza di un enzima, la reazione si muove nella stessa direzione come sarebbe senza l’enzima, tuttavia la presenza dell’enzima accelera il processo.
Funzione e natura degli enzimi
Gli enzimi sono responsabili di:
1. Trasduzione del segnale e regolazione cellulare spesso da chinasi e fosfatasi.
2. Generazione di movimento con miosina (proteina muscolare) idrolizzando ATP per generare contrazione muscolare.
3. Trasporto del carico intorno alla cellula come parte del citoscheletro.
4., Digestione,metabolismo, respirazione
5. Enzimi digestivi come amilasi e proteasi abbattere grandi molecole di amidi o proteine in quelli più piccoli per un corretto assorbimento nell’intestino.
6. Produzione di ormoni.
7. Assorbimento dei nutrienti e trasporto.
8. Riparazione cellulare e divisione.
9. Disintossicazione
10. Malattia: i virus possono contenere enzimi per infettare le cellule, cioè l’integrasi dell’HIV e la trascrittasi inversa.
Enzimi
1. Stabilizzare lo stato di transizione: a., Creare un ambiente con una distribuzione di carica complementare a quella dello stato di transizione per abbassare la sua energia.
2. Fornire un percorso di reazione alternativo: a. Reagisce temporaneamente con il substrato, formando un intermedio covalente per fornire uno stato di transizione energetica inferiore.
3. Destabilizza lo stato fondamentale del substrato: a. Distorcere le sottrazioni legate nella loro forma di stato di transizione per ridurre l’energia necessaria per raggiungere lo stato di transizione. b. Orientare i substrati in una disposizione produttiva per ridurre il cambiamento di entropia di reazione (termodinamica).,
Gli enzimi reagiscono essenzialmente con altre sostanze, sia per smontarli o unirli insieme.
Gli enzimi sono divisi come:
1. Semplice: contiene solo la parte proteica (ad esempio, idrolasi come pepsina, tripsina o ribonucleasi).
2. Complesso: le proteine possono essere unite con una parte non proteica, indicata come gruppi protesici. La parte proteica è chiamata apoenzima. La parte non proteica è indicata come cofattore. Insieme, apoenzima e cofattore, formano una molecola biologicamente attiva di enzima-l’oloenzima.
Cofattori:
a., ion metallico: aiuta l’enzima a posizionare la molecola del substrato nel sito attivo. Chiamati attivatori, i metalli associati possono includere rame, cobalto, zinco, magnesio, molibdeno e manganese.
b. Molecola organica: spesso vitamine come riboflavina, le vitamine del gruppo B e vitamina C.
c. Coenzimi: una molecola organica non proteica che si lega alla molecola di apoenzima liberamente, quindi può staccarsi da esso, cioè NAD +(Nicotinamide adenina dinucleotide) e NADP+ (Nicotinamide adenina dinucleotide fosfato). NAD + e NADP + sono portatori di elettroni nella respirazione cellulare., NADP + è creato in reazione anabolica, o reazione che costruisce grandi molecole da piccole molecole.
d. Gruppo protesico: una molecola organica non proteica che si lega strettamente alla molecola dell’apoenzima, cioè eme, FAD (flavina adenina dinucleotide)
Un substrato
Le molecole su cui reagiscono gli enzimi sono chiamate substrato. L’enzima rimane intatto e non viene consumato durante le reazioni chimiche. Né alterano la stabilità di una reazione. Invece, supportano la progressione di una reazione mantenendo l’equilibrio., La maggior parte degli enzimi sono proteine costituite da aminoacidi, gli elementi costitutivi di base all’interno del corpo.
Ci sono eccezioni con alcuni tipi di molecole di RNA chiamate ribozimi. Le molecole di aminoacidi sono collegate attraverso legami noti come legami peptidici che formano proteine.
Gli enzimi sono costituiti da un diverso numero di catene peptidiche e sono chiamati complessi multienzimatici. Un esempio di complessi multienzimatici sarebbe l’acido grasso sintasi, un enzima che catalizza la sintesi di acidi grassi superiori nelle cellule., Chimicamente, i piccoli gruppi di amminoacidi legati sono chiamati molecole polimeriche o indicati nella biochimica come poli peptidi.
Ci vogliono 30 aminoacidi per formare una catena abbastanza lunga che consentono alle molecole di influenzare la propria forma nel diventare una proteina. Che si tratti di una catena o di più catene, contiene più parti chiamate domini. Le proteine servono numerose funzioni biochimiche tra cui caratteristiche strutturali anatomiche in organismi, portatori di nutrienti, antigeni e ormoni.,
Il complesso enzimatico – substrato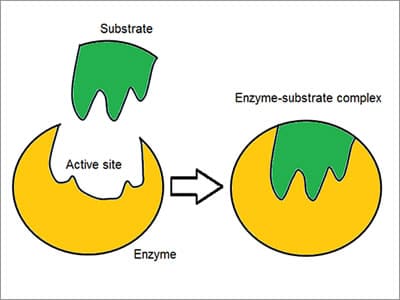 Coniato come modello “Lock and key”, gli enzimi reagiscono con altre sostanze per smontarli o unirli insieme. Esiste un’elevata specificità degli enzimi dimostrata dal modo in cui si associano o si legano al substrato: la molecola reagente. Chemoselettivo, ogni molecola enzimatica ha un sito attivo sulla sua superficie. La molecola reagente è attratta e modellata nella rientranza che forma il sito attivo.,
Coniato come modello “Lock and key”, gli enzimi reagiscono con altre sostanze per smontarli o unirli insieme. Esiste un’elevata specificità degli enzimi dimostrata dal modo in cui si associano o si legano al substrato: la molecola reagente. Chemoselettivo, ogni molecola enzimatica ha un sito attivo sulla sua superficie. La molecola reagente è attratta e modellata nella rientranza che forma il sito attivo.,
La specificità si ottiene legando tasche con complementare, forma, carica e caratteristica idrofila/idrofobica ai substrati. Il sito attivo continua a cambiare fino a quando il substrato non è completamente legato, ottenendo una forma finale.
Detto questo, gli enzimi sono strutture flessibili e il sito attivo viene continuamente rimodellato dall’interazione con il substrato mentre interagisce con l’enzima.
Controllo dell’attività enzimatica
Gli enzimi guidano e regolano il metabolismo di una cellula e sono attentamente controllati., Il meccanismo d’azione degli enzimi coinvolge molecole regolatrici che possono aumentare (attivatore) o inibire (inibitori) l’attività di un enzima. Un inibitore enzimatico è una molecola che si lega a un enzima e blocca il legame di un substrato, diminuendo la sua attività. Se un enzima produce troppo di una sostanza in un organismo, quella sostanza inizia ad agire come un inibitore per l’enzima all’inizio del percorso come una forma di feedback negativo, rallentando la reazione verso il basso. I farmaci possono essere inibitori enzimatici., Ad esempio, bloccare l’attività di un enzima può uccidere un agente patogeno o correggere uno squilibrio metabolico.
Il controllo dell’attività enzimatica è essenziale per l’omeostasi nell’organismo. Quando c’è malfunzionamento di un enzima come una mutazione, sopra o sotto produzione, o delezione, questo può portare a una malattia genetica. In alcuni casi, può essere fatale. Ad esempio, l’insufficienza pancreatica è una condizione che si verifica quando il pancreas non produce abbastanza di un enzima specifico necessario per digerire il cibo nell’intestino tenue.,
Tabella 1 – Fattori che influenzano o controllano l’attività enzimatica
Modulazione della temperatura
L’attività catalitica degli enzimi richiede una temperatura ottimale all’interno del corpo. Gli enzimi umani hanno attività massima a 37oC. Gli enzimi possono diventare vulnerabili ai cambiamenti di temperatura. A causa della loro natura proteica, l’applicazione di alte temperature tra 55-60o C provoca la denaturazione delle proteine, producendo un cambiamento conformazionale e la distruzione delle proteine. Questo cambiamento provoca un calo o un arresto completo della reazione., Inoltre, le basse temperature possono rallentare le reazioni, riducendo l’attività degli enzimi.
pH
Gli enzimi sono sensibili al cambiamento del pH. Come nei cambiamenti di temperatura, gli estremi di basso e alto portano nuovamente alla denaturazione delle molecole. La concentrazione di H + influenza la ionizzazione dei gruppi acidi e basici
Fonti enzimatiche
1. Enzimi metabolici: regola organi, tessuti e sangue. Aiuta a creare nuove cellule, riparare le cellule danneggiate esistenti e sposta i nutrienti dove il tuo corpo ne ha più bisogno.
2. Enzimi digestivi: rompe il cibo. Sottotipi-amilasi, lipasi, proteasi
3., Cibi crudi: supporta il sistema immunitario, la riparazione cellulare.
Ci sono sei classi principali di enzimi con funzione specifica. Ci sono anche sottogruppi.
Tabella 2 – Tipi di enzimi
Sottogruppi enzimatici:
Le idrolasi sono enzimi che separano l’acqua, separando le parti delle molecole.
Idrogenasi sono enzimi che aggiungono atomi di idrogeno ad altre molecole; 5 alfa reduttasi è un esempio.
Le ossidasi catalizzano le ossidazioni aggiungendo ossigeno o elettroni a molecole o atomi.,
 Enzimi nella pelle; Costruzione della barriera cutanea e del processo di desquamazione finale
Enzimi nella pelle; Costruzione della barriera cutanea e del processo di desquamazione finale
L’intero processo di differenziazione epidermica dipende dall’attività enzimatica. Le idrolasi lipidiche sono responsabili della conversione dei lipidi in ceramidi e acidi grassi liberi. Gli enzimi sono coinvolti nella modificazione del profilaggrin e nell’elaborazione proteolitica nell’epidermide. Le fasi di transizione sane dell’intero processo di costruzione dello strato corneo sono vitali e dipendono dagli enzimi.,
Gli enzimi proteasi sono essenziali per il normale processo di desquamazione all’interno delle cellule dello strato corneo (SC). I desmosomi sono importanti per una forte adesione da cellula a cellula. Il processo di desquamazione comporta la proteolisi delle strutture adesive intercellulari create nelle strutture del desmosoma. Ci sono enzimi proteasi specifici all’interno dello strato corneo chiamati enzima triptico e enzima chimotriptico coinvolti nella degradazione dei corneodesmosomi. Due proteine trovate in desmosomi sono desmoglein e desmocollin, situati alle interconnessioni all’interno delle cellule.,
L’enzima chimotriptico dello strato corneo è prodotto come precursore inattivo senza attività proteolitica. Quindi c’è un requisito di un enzima attivante che coinvolge un enzima con substrato simile alla tripsina. Diverse proteasi attaccano i diversi siti di aminoacidi sulle proteine desmoglein e desmocollin. Quando i legami sono indeboliti, si rompono, permettendo alle cellule di sfaldarsi.
Il processo di desquamazione richiede acqua dall’interno dell’epidermide e un pH normale. L’orchestrazione di tutte le attività biologiche è complessa e deve lavorare sinergicamente tra loro.
1., Pugliese, Peter T. MD. (2005) Appendice A. Enzimi e attività enzimatica. Advanced Professional Skin Care-Edizione medica. p 390-392 L’agente topico, LLC, Burnsville, PA
2. Enzima. Wikipedia.org Estratto da https://en.wikipedia.org/wiki/Enzyme
3. IBID-Pugliese-Ref 1
4. IBID-Lavrikova p.
5. Autore del sottocapitolo: Petra Lavrikova. Capitolo 6. Enzima. Funzione delle cellule e del corpo umano. Estratto da http://fblt.cz/en/skripta/ii-premena-latek-a-energie-v-bunce/6-enzymy/
6. IBID-Lavrikova p.
7. IBID-Pugliese
8. IBID-cfr.rif. 2
9. Regolazione enzimatica., Biologia Energia ed enzimi recuperati da https://www.khanacademy.org/science/biology/energy-and-enzymes/enzyme-regulation/a/enzyme-regulation
10. Inibitore enzimatico recuperato da https://en.wikipedia.org/wiki/Enzyme _inhibitor
11. Insufficienza pancreatica. Digestive Disease Center, Medical University della Carolina del Sud. Estratto da http://ddc.musc.edu/public/diseases/pancreas-biliary-system/pancreatic-insufficiency.html
12. Regolazione enzimatica. Biologia Energia ed enzimi. Khan Academy p. 2 Estratto da https://www.khanacademy.org/science/biology/energy-and-enzymes/enzyme-regulation/a/enzyme-regulation
13. IBID-Lavrikova, pag. 5
14. Snyder, Kimberly. (06 Dicembre 2017) Come gli enzimi influenzano la bellezza e la salute. Estratto da https://www.huffingtonpost.com/kimberly-snyder/enzymes-beauty-health_b_1201847.html
15. IBID-Pugliese pg 391
16., IBID-Lavrikova p 7
17. Preland, R., Rothnagel, J., Lawrence, O. (2006)Capitolo 9, Profilaggrin e la famiglia S100 fusa delle proteine leganti il calcio. Barriera cutanea, Elias& Feingold.
18. Ekholm, E., Brattasnd, M., Egelrud, T. (gen. 2000) Enzima triptico dello strato corneo nell’epidermide normale: un anello mancante nel processo di desquamazione? Il suo nome deriva dal latino”div id=”6067593f19″ >
19. IBID-Pugliese-Ref 1
20. IBID-Rif 17, pag. 56