en chauffant, les liquides se dilatent car les molécules se déplacent avec plus d’énergie en surmontant l’attraction intermoléculaire. Au contraire, les liquides se contractent généralement au refroidissement. C’est parce que les molécules se déplacent plus lentement et ne sont pas capables de surmonter la force d’attraction entre elles. Quand ils gèlent, ils se contractent un peu plus pour former une structure solide rigide avec un minimum d’espaces intermoléculaires entre eux. Mais ce n’est pas le cas avec de l’eau. Au lieu de se contracter, il se développe.,
Le point de Vue Moléculaire
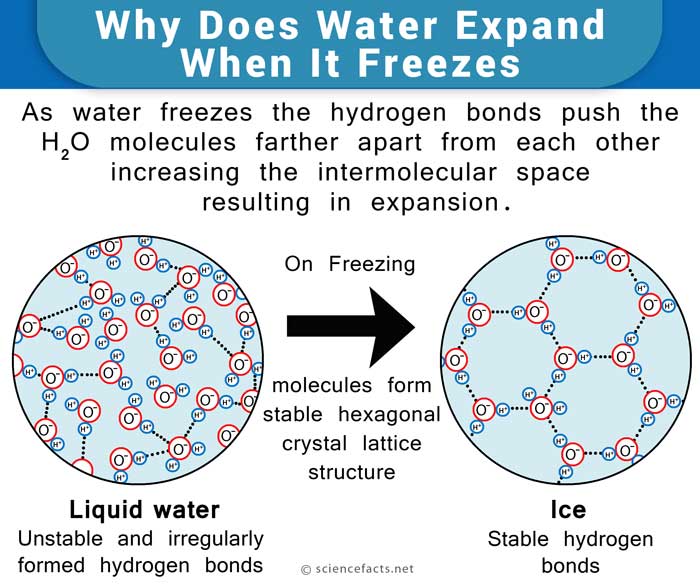
La molécule d’eau, composée de 2 atomes d’hydrogène et un d’oxygène forme une tête de Mickey Mouse-comme la structure, tels que les oreilles sont les atomes d’hydrogène et de la tête est représentée par l’atome d’oxygène. Le côté atome d’oxygène de la molécule est légèrement négatif tandis que le côté atomes d’hydrogène a une légère charge positive. Cela fait que les molécules d’eau attirées les unes vers les autres forment des liaisons hydrogène. Lors de la congélation, les molécules se mettent dans un arrangement qui est très ouvert dans la nature et contient plus d’espace que l’eau à l’état liquide., Par conséquent, on dit que l’eau se dilate au gel et devient moins dense. D’autre part, il se contracte lors de la décongélation, contrairement à la plupart des autres liquides.