Levels of Protein Structure
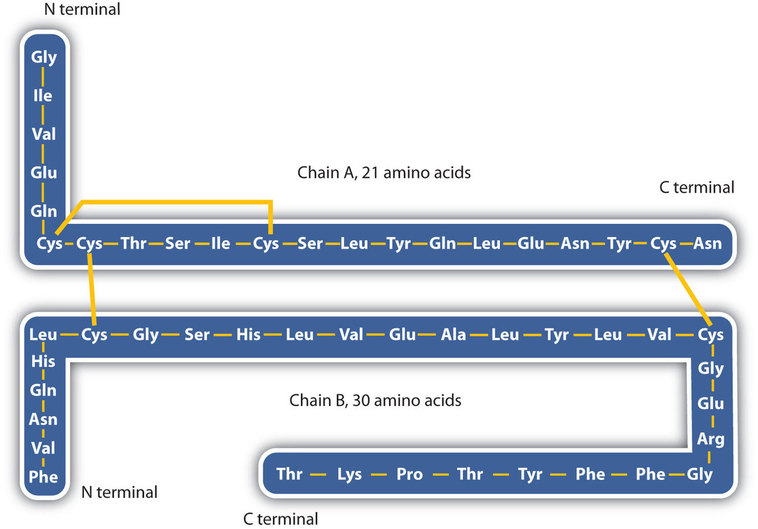
The structure of proteins is generally described as having four organizational levels. A primeira delas é a estrutura primária, que é o número e sequência de aminoácidos na cadeia ou cadeias polipeptídicas de uma proteína, começando com o grupo amino livre e mantido pelas ligações peptídicas ligando cada aminoácido ao próximo. A estrutura primária da insulina, composta por 51 aminoácidos, é mostrada na figura \(\PageIndex{1}\).,
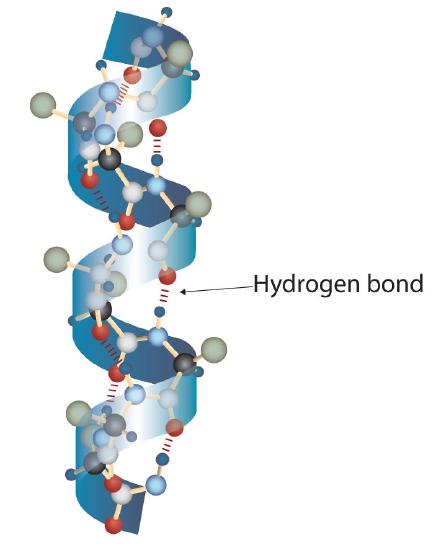
uma molécula de proteína não é um emaranhado aleatório de cadeias polipeptídicas. Em vez disso, as cadeias são dispostas em conformações únicas, mas específicas. O termo estrutura secundária refere-se ao arranjo fixo da espinha dorsal polipeptídica., Com base em estudos de Raio-X, Linus Pauling e Robert Corey postularam que certas proteínas ou porções de proteínas se torçam em espiral ou hélice. Esta hélice é estabilizada por intrachain de hidrogênio a ligação entre a carbonila átomo de oxigênio de um aminoácido e o de amida átomo de hidrogênio quatro aminoácidos na cadeia (localizado na próxima curva da hélice) e é conhecido como um destro α-hélice. Dados de raios X indicam que esta hélice faz uma curva para cada 3,6 aminoácidos, e as cadeias laterais destes aminoácidos projectam-se para fora da coluna vertebral enrolada (figura \(\Pagindex{2}\))., As α-queratinas, encontradas no cabelo e na lã, são exclusivamente α-helicoidais em conformação. Algumas proteínas, como a gama globulina, a quimotripsina e o citocromo c, têm pouca ou nenhuma estrutura helicoidal. Outros, como hemoglobina e mioglobina, são helicoidais em certas regiões, mas não em outras.
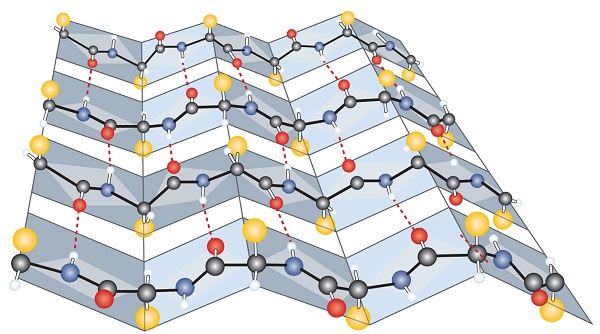
outro tipo comum de estrutura secundária, chamado de conformação de folha de β, é um esquema em que duas ou mais cadeias polipeptídicas estendidas (ou regiões separadas na mesma cadeia) estão alinhadas lado a lado. Alinhado segmentos podem executar em paralelo ou antiparallel—isto é, o N-terminais podem enfrentar na mesma direção em cadeias adjacentes, ou em direções diferentes—e são conectados por interchain ligação de hidrogênio (Figura \(\PageIndex{3}\))., A folha de β-pleated é particularmente importante em proteínas estruturais, como a fibroina de seda. Também é visto em porções de muitas enzimas, tais como carboxipeptidase a e lisozima.
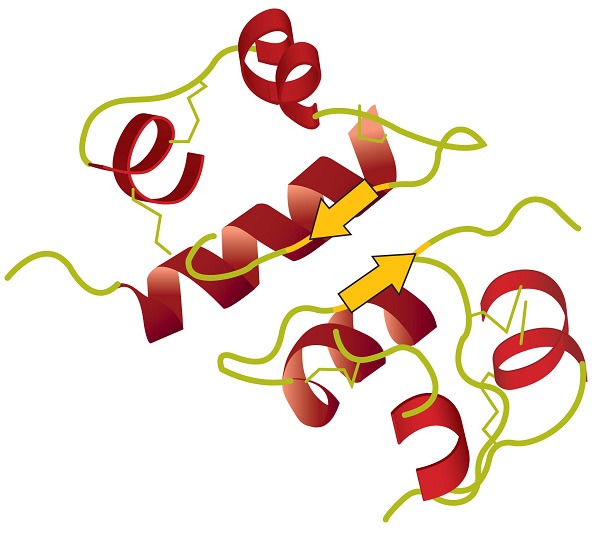
estrutura terciária refere-se à forma tridimensional única da proteína como um todo, que resulta da dobragem e flexão da espinha dorsal proteica. A estrutura terciária está intimamente ligada ao bom funcionamento bioquímico da proteína. A figura \(\PageIndex{4}\) mostra uma representação da estrutura tridimensional da insulina.
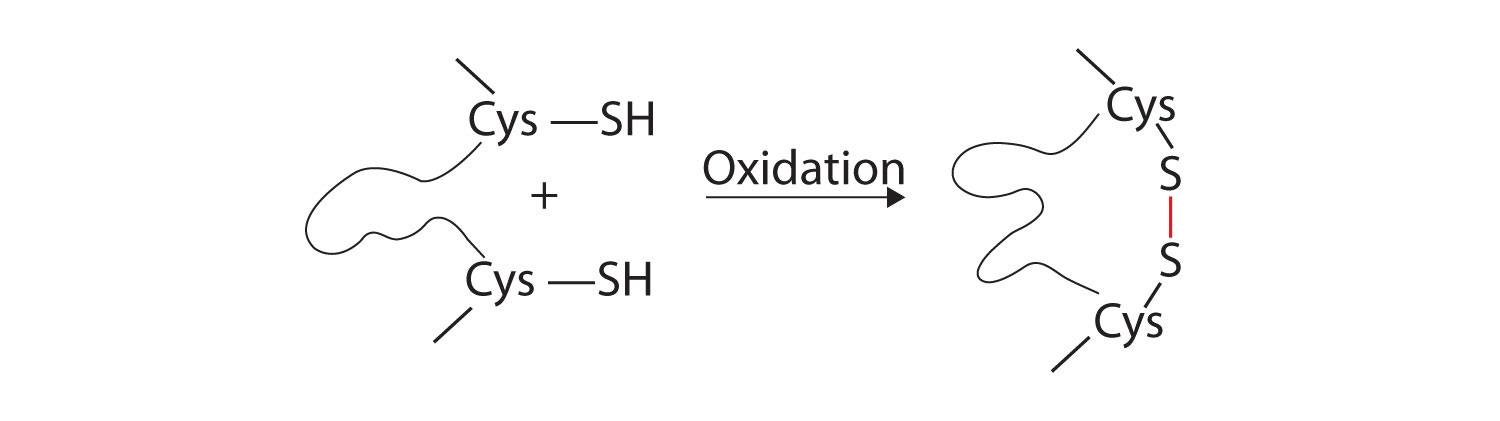
quatro grandes tipos de interações atraentes determinam a forma e a estabilidade da estrutura terciária das proteínas. Você estudou vários deles anteriormente.ligação iónica. Ligações iônicas resultam de atrações eletrostáticas entre cadeias laterais positivas e negativamente carregadas de aminoácidos., Por exemplo, a atração mútua entre um íon ácido aspártico carboxilato e um íon lisina amônio ajuda a manter uma determinada área dobrada de uma proteína (parte (a) da figura \(\PageIndex{5}\)).ligação a hidrogénio. A ligação do hidrogênio forma-se entre um átomo de oxigênio altamente eletronegativo ou um átomo de nitrogênio e um átomo de hidrogênio ligado a outro átomo de oxigênio ou nitrogênio, como os encontrados em cadeias laterais de aminoácidos polares., A ligação de hidrogênio (bem como atrações iônicas) é extremamente importante tanto nas interações intra – e intermoleculares das proteínas (parte b) da figura \(\PageIndex{5}\)).ligações por dissulfureto. Duas unidades de aminoácidos de cisteína podem ser unidas como a molécula de proteína se dobra. A oxidação subsequente e a ligação dos átomos de enxofre nos grupos sulfidril (SH) altamente reactivos conduz à formação de cistina [parte (C) da figura \(\PageIndex{5}\)]., As ligações de dissulfureto intracain são encontradas em muitas proteínas, incluindo insulina (barras amarelas Na Figura \(\PageIndex{1}\)) e têm um forte efeito estabilizador na estrutura terciária.
- forças de dispersão. Forças de dispersão surgem quando um átomo normalmente não-polar se torna momentaneamente polar devido a uma distribuição desigual de elétrons, levando a um dipolo instantâneo que induz uma mudança de elétrons em um átomo não-polar vizinho., As forças de dispersão são fracas, mas podem ser importantes quando outros tipos de interações estão ausentes ou mínimas (Parte (d) da figura \(\PageIndex{5}\)). Este é o caso da fibroina, a principal proteína da seda, na qual uma alta proporção de aminoácidos na proteína tem cadeias laterais não-polares. O termo interação hidrofóbica é frequentemente usado como sinônimo de forças de dispersão. Interações hidrofóbicas surgem porque as moléculas de água se envolvem em ligação de hidrogênio com outras moléculas de água (ou grupos em proteínas capazes de ligação de hidrogênio)., Como os grupos não-polares não podem se envolver em ligações de hidrogênio, as proteínas dobram de tal forma que estes grupos são enterrados na parte interior da estrutura proteica, minimizando seu contato com a água.
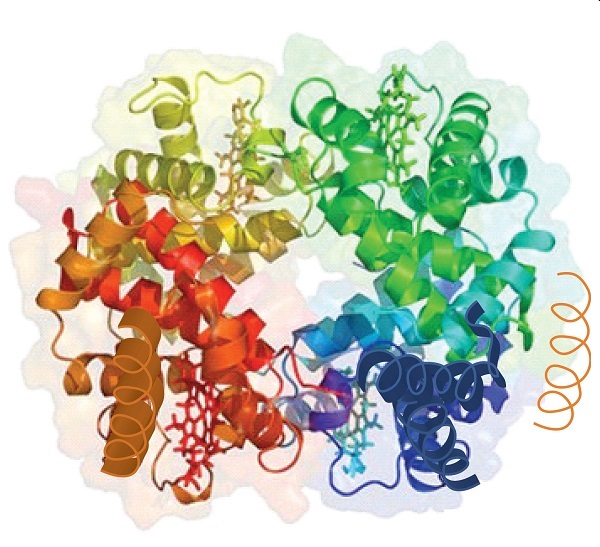
Quando uma proteína contém mais de uma cadeia polipeptídica, cada cadeia é chamada de subunidade. O arranjo de várias subunidades representa um quarto nível de estrutura, a estrutura quaternária de uma proteína. A hemoglobina, com quatro cadeias polipeptídicas ou subunidades, é o exemplo mais frequentemente citado de uma proteína com estrutura quaternária (figura \(\PageIndex{6}\))., A estrutura quaternária de uma proteína é produzida e estabilizada pelos mesmos tipos de interações que produzem e mantêm a estrutura terciária. Uma representação esquemática dos quatro níveis da estrutura proteica está na figura \(\PageIndex{7}\).
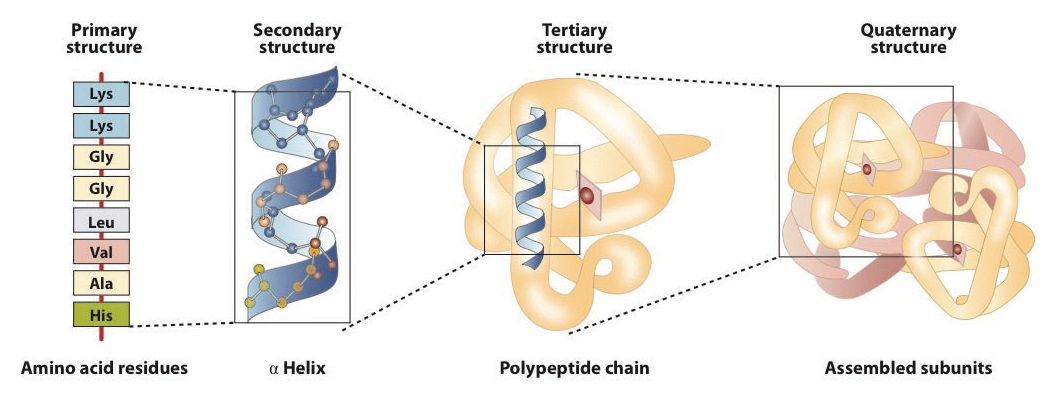
A estrutura primária consiste em específico sequência de aminoácidos. A cadeia peptídica resultante pode torcer-se numa α-hélice, que é um tipo de estrutura secundária. Este segmento helicoidal é incorporado à estrutura terciária da cadeia polipeptídica dobrada., A única cadeia polipeptídica é uma subunidade que constitui a estrutura quaternária de uma proteína, como hemoglobina que tem quatro cadeias polipeptídicas.