os Objectivos de Aprendizagem
Depois de concluir esta seção, você deve ser capaz
-
- escreva uma equação para representar a formação de um sabão.identificar a estrutura da gordura necessária para produzir um determinado sabão.identificar a estrutura de um sabão, dada a estrutura da gordura a partir da qual é produzido.descreva o mecanismo pelo qual os sabões exercem a sua acção de limpeza.,dar uma explicação química dos problemas encontrados quando os sabões de carboxilato são utilizados em zonas de água dura e explicar como podem ser superados pela utilização de detergentes de sulfonato.
termos-chave
certifique-se de que pode definir, e usar no contexto, os termos-chave abaixo.,ácidos e sais carboxílicos de cadeias alquilicas superiores a oito carbonos apresentam um comportamento incomum na água devido à presença de regiões hidrofílicas (CO2) e hidrofóbicas (Alquil) na mesma molécula. Tais moléculas são denominadas anfifílicas (Gk. amphi = ambos) ou anfipático. Ácidos gordos compostos por dez ou mais átomos de carbono são quase insolúveis na água, e devido à sua menor densidade, flutuam na superfície quando misturados com água., Ao contrário da parafina ou de outros alcanos, que tendem a poça na superfície das águas, estes ácidos graxos se espalham uniformemente sobre uma superfície de água estendida, eventualmente formando uma camada monomolecular na qual os grupos carboxilo polar são ligados por hidrogênio na interface de água, e as cadeias de hidrocarbonetos estão alinhadas em conjunto longe da água. Este comportamento é ilustrado no diagrama à direita. As substâncias que se acumulam na superfície da água e alteram as propriedades da superfície são denominadas tensioactivos.,
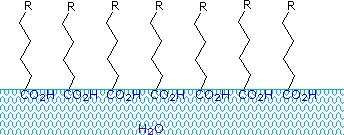
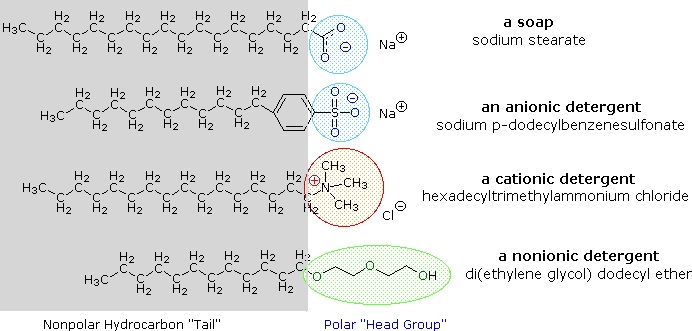
alcalino metal sais de ácidos gordos são mais solúveis na água do que os próprios ácidos, e o carácter anfifílico destas substâncias também os tornam fortes tensioactivos. Os exemplos mais comuns de tais compostos são sabões e detergentes, quatro dos quais são mostrados abaixo. Note que cada uma destas moléculas tem uma cadeia de hidrocarbonetos não-polares, a “cauda”, e um”grupo de cabeça” polar (muitas vezes iônico)., A utilização de tais compostos como agentes de limpeza é facilitada pelo seu carácter surfactante, que reduz a tensão superficial da água, permitindo-lhe penetrar e molhar uma variedade de materiais.
quantidades muito pequenas destes tensoactivos dissolvem-se na água para dar uma dispersão aleatória de moléculas solúveis. No entanto, quando a concentração é aumentada, ocorre uma mudança interessante. As moléculas surfactantes juntam-se reversivelmente em agregados polimoleculares chamados micelas., Ao reunir as cadeias hidrofóbicas no centro da micela, a ruptura da estrutura de ligação de hidrogênio da água líquida é minimizada, e os grupos polares se estendem para a água circundante, onde eles participam da ligação de hidrogênio. Estas micelas têm muitas vezes uma forma esférica, mas também podem assumir formas cilíndricas e ramificadas, como ilustrado à direita. Aqui o grupo da cabeça polar é designado por um círculo azul, e a cauda não-polar é uma linha preta zig-zag.
o mais antigo agente de limpeza anfifílica conhecido pelos seres humanos é o sabão., O sabão é fabricado pela hidrólise catalizada de base (saponificação) da gordura animal (ver abaixo). Antes de O hidróxido de sódio estar disponível comercialmente, foi utilizada uma solução de ebulição de carbonato de potássio branqueado a partir de cinzas de madeira. Sabões de potássio moles foram então convertidos para sabões de sódio mais duros por lavagem com solução de sal. A importância do sabão para a civilização humana é documentada pela história, mas alguns problemas associados com seu uso foram reconhecidos. Uma delas é causada pela acidez fraca (PKA ca. 4.9) dos ácidos gordos., As soluções de sabões metálicos alcalinos são ligeiramente alcalinas (pH 8 a 9) devido à hidrólise. Se o pH de uma solução de sabão é reduzido por contaminantes ácidos, ácidos gordos insolúveis precipitam e formam uma escumalha. Um segundo problema é causado pela presença de sais de cálcio e magnésio no abastecimento de água (água dura). Estes cátions divalentes causam agregação das micelas, que depois depositam como escumalha suja.estes problemas têm sido atenuados pelo desenvolvimento de anfifilos sintéticos chamados detergentes (ou syndets)., Usando um ácido muito mais forte para o grupo da cabeça polar, as soluções de água do anfípio são menos sensíveis às mudanças de pH. Também as funções de sulfonato usadas para virtualmente todos os detergentes aniônicos conferem maior solubilidade nas micelas incorporando os catiões alcalinos da terra encontrados em água dura. Variações sobre o tema anfípio levaram ao desenvolvimento de outras classes, como os detergentes catiónicos e não iónicos mostrados acima. Os detergentes catiónicos apresentam frequentemente propriedades germicidas, e a sua capacidade de alterar o pH superficial tornou-os úteis como amaciadores de tecidos e condicionadores de cabelo., Estes versáteis química “ferramentas” radicalmente transformado doméstico e de cuidados pessoais, limpeza de mercados de produtos ao longo dos últimos cinquenta anos
Reações Químicas de Óleos e Gorduras
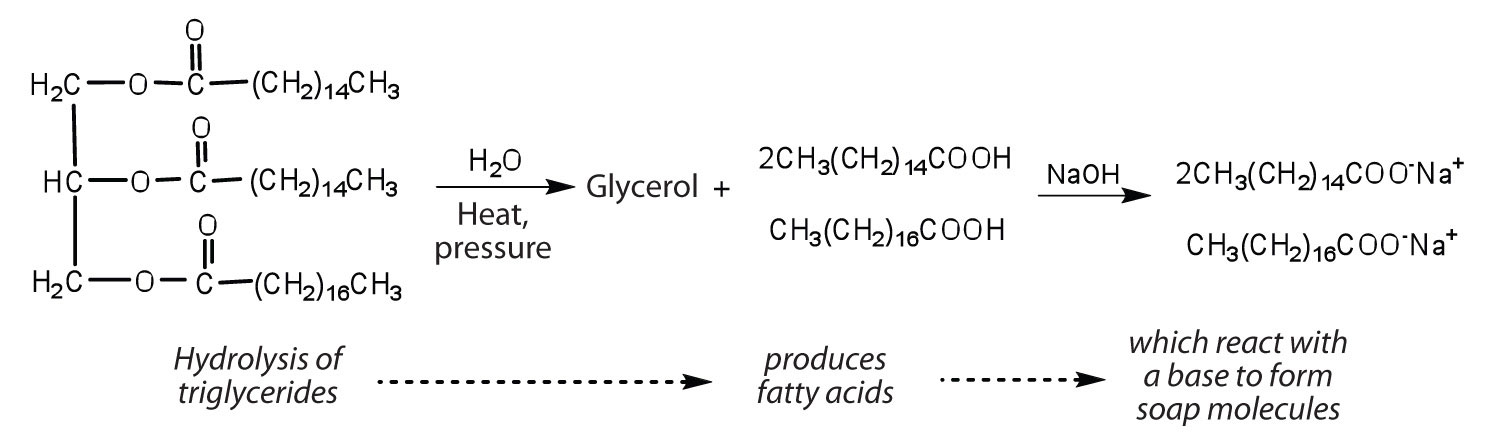
as Gorduras e os óleos podem participar em uma variedade de reações químicas, por exemplo, porque os triglicerídeos são os ésteres, eles podem ser hidrolisado na presença de um ácido, uma base, ou enzimas específicas, conhecidas como lipases. A hidrólise de gorduras e óleos na presença de uma base é usada para fazer sabão e é chamado de saponificação., Hoje a maioria dos sabões são preparados através da hidrólise de triglicéridos (muitas vezes a partir de sebo, óleo de coco, ou ambos) usando água sob alta pressão e temperatura . Carbonato de sódio ou hidróxido de sódio, em seguida, é usado para converter os ácidos graxos para seus sais de sódio (sabão moléculas):
Colaboradores e Atribuições
-
o Dr. Dietmar Kennepohl FCIC (Professor de Química, Athabasca University)
-
Prof. Steven Agricultor (Sonoma State University)
-
William Reusch, Professor Emérito (Michigan State U.,), Virtual Textbook of Organic Chemistry
- The Basics of General, Organic, and Biological Chemistry by David W. Ball, John W. Hill, and Rhonda J. Scott.