massa atômica
massas de átomos individuais são muito, muito pequenas. Usando um dispositivo moderno chamado espectrômetro de massa, é possível medir tais massas minúsculas. Um átomo de oxigénio-16, por exemplo, tem uma massa de \(2, 66 \vezes 10^{-23} \: \text{g}\). Embora comparações de massas medidas em gramas tenham alguma utilidade, é muito mais prático ter um sistema que nos permita comparar mais facilmente as massas atômicas relativas., Os cientistas decidiram usar o nuclídeo de carbono-12 como o padrão de referência pelo qual todas as outras massas seriam comparadas. Por definição, a um átomo de carbono-12 é atribuída uma massa de 12 unidades de massa atómica \(\esquerda (\text{amu} \direita)\). Uma unidade de massa atômica é definida como uma massa igual a um duodécimo da massa de um átomo de carbono-12. A massa de qualquer isótopo de qualquer elemento é expressa em relação ao padrão carbono-12. Por exemplo, um átomo de hélio-4 tem uma massa de \(4.0026 \: \text{amu}\). Um átomo de enxofre-32 tem uma massa de \(31.972 \: \text{amu}\).,
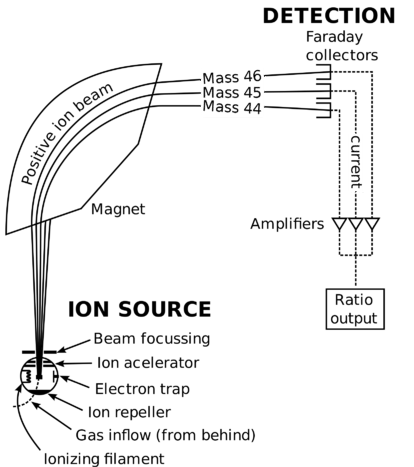
espectrómetro de massa esquemático.
O átomo de carbono-12 tem seis protões e seis neutrões no seu núcleo para um número de massa de 12. Uma vez que o núcleo é responsável por quase toda a massa do átomo, um único próton ou um único nêutron tem uma massa de aproximadamente \(1 \: \text{amu}\). No entanto, como visto pelos exemplos de hélio e enxofre, as massas de átomos individuais não são números inteiros., Isto ocorre porque a massa de um átomo é afetada muito levemente pelas interações das várias partículas dentro do núcleo, e a pequena massa do elétron é levada em conta.