o estado de oxidação de um átomo é a carga deste átomo após a aproximação iónica das suas ligações heteronucleares. O número de oxidação é sinônimo do Estado de oxidação. Determinar os números de oxidação da estrutura de Lewis (figura 1a) é ainda mais fácil do que deduzi-los da Fórmula molecular (figura 1b). O número de oxidação de cada átomo pode ser calculado subtraindo a soma dos pares solitários e electrões que obtém das ligações do número de electrões de Valência., As ligações entre átomos do mesmo elemento (ligações homonucleares) são sempre divididas igualmente.
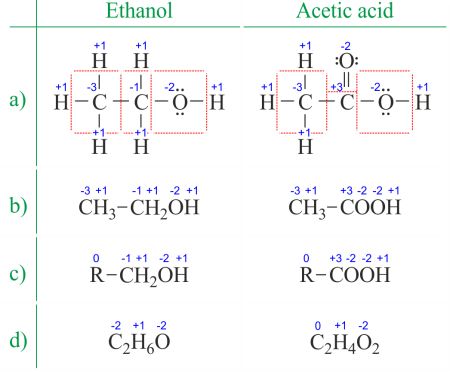
ao lidar com compostos orgânicos e fórmulas com múltiplos átomos do mesmo elemento, é mais fácil trabalhar com fórmulas moleculares e números médios de oxidação (figura 1d). Compostos orgânicos podem ser escritos de tal forma que qualquer coisa que não mude antes da primeira ligação C-C seja substituída pela abreviatura R (figura 1c). Ao contrário dos radicais em moléculas orgânicas, R não pode ser hidrogênio. Uma vez que os elétrons entre dois átomos de carbono estão uniformemente espalhados, o grupo R não altera o número de oxidação do átomo de carbono a que está ligado., Você pode encontrar exemplos de uso na dividir a reação redox em duas páginas de meia-reações.
regras para atribuir números de oxidação
- o número de oxidação de um elemento livre é sempre 0.
- o número de oxidação de um íon monatômico é igual à carga do íon.o flúor em compostos é sempre atribuído um número de oxidação de -1.os metais alcalinos (Grupo I) têm sempre um número de oxidação de +1.aos metais alcalinos da terra (grupo II) é sempre atribuído um número de oxidação de +2.,o oxigênio quase sempre tem um número de oxidação de -2, exceto em peróxidos (H2O2) onde é -1 e em compostos com flúor (OF2) onde é +2.
- hidrogênio tem um número de oxidação de +1 quando combinado com não-metais, mas tem um número de oxidação de -1 quando combinado com metais.
- a soma algébrica dos números de oxidação de elementos num composto é zero.
- a soma algébrica dos estados de oxidação em um íon é igual à carga sobre o íon.