Introduction
La Fièvre du Chikungunya est une maladie virale transmise par la piqûre de moustiques Aedes infectés. La maladie consiste généralement en une maladie aiguë avec fièvre, éruption cutanée et arthralgie invalidante. Le mot chikungunya signifie « marcher penché » dans le dialecte africain Makonde, et fait référence à l’effet de l’arthralgie incapacitante observée chez les patients atteints.1 le virus du Chikungunya (CHIKV) est l’agent étiologique et un membre du genre Alphavirus dans la famille des Togaviridae.,2
des cas de Chikungunya se produisent en Afrique, en Asie et dans le sous-continent indien. Les infections humaines en Afrique sont à des niveaux relativement faibles depuis un certain nombre d’années. En décembre 2013, la France a signalé 2 cas autochtones confirmés en laboratoire dans la partie française de L’île caribéenne de St Martin. Depuis lors, la transmission locale a été confirmée dans plus de 43 pays et territoires de la région américaine.3 Il s’agissait de la première épidémie documentée de CHIKV avec transmission autochtone dans les Amériques; par conséquent, il est sujet de grande préoccupation sur notre continent.,
génome, structure et réplication du CHIKV
le virus du Chikungunya est un virus à ARN plus brin enveloppé à symétrie icosaédrique. Le virion a un diamètre de 70 nm et il est composé d’unités répétitives des glycoprotéines transmembranaires E1 et E2 (240 hétérodimères de E2/E1 disposés sous forme de pointes trimériques à sa surface), de la capside (C), d’une bicouche lipidique dérivée de l’hôte et d’une seule molécule d’ARN génomique.4 le génome a une longueur d’environ 12 Ko et Code les protéines non structurales (NSP) à l’extrémité 5′ et les protéines structurelles à l’extrémité 3′., Les NSP sont traduits à partir de L’ARN génomique et les protéines structurelles à partir d’un ARN sous-génomique (Fig. 1).5
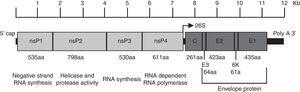
organisation du génome du virus chikungunya. La figure montre les protéines non structurales et structurelles de la façon dont elles sont organisées dans tout le génome ainsi que les régions non traduisibles en 5′ et 3′. La fonction et la taille en acides aminés sont montrées pour chaque protéine. La figure est dessinée à l’échelle basée sur le génome CHIKV avec le numéro D’accès GenBank: AM258990., Les tailles de régions non traduisibles ont été obtenues à partir de Hyde et al.92 la figure a été adaptée de Weaver61 et Solignat.93 nsP, protéine non structurale; C, capside; E, enveloppe; AA, acide aminé.
Alphavirus entrer dans les cellules cibles par endocytose. Quelques récepteurs (signe DC, signe L, sulfate d’héparine, laminine et intégrines) ont été impliqués dans ce processus, mais leurs rôles précis n’ont pas été clairement prouvés.5 récemment, la prohibitine a été identifiée comme protéine réceptrice du CHIKV.,6 suite à l’endocytose, l’environnement acide de l’endosome déclenche des changements conformationnels dans l’enveloppe virale qui exposent le peptide E1, qui Médie la fusion de la membrane cellulaire virus–hôte. Cela permet la livraison cytoplasmique du noyau et la libération du génome viral. Deux précurseurs de protéines non structurales sont traduits à partir de l’ARNm viral, et le clivage de ces précurseurs génère nsP1–nsP4.7 ces protéines s’assemblent pour former le complexe de réplication virale, qui synthétise un intermédiaire d’ARN à brin négatif sur toute la longueur., Ceci Sert de modèle pour la synthèse des ARN sous-génomiques (26S) et génomiques (49s). L’ARN sous-génomique entraîne l’expression du précurseur de la polyprotéine c–pE2–6k–E1, qui est traité par autoprotolyse. La capside est libérée et un traitement ultérieur génère les glycoprotéines pE2 et E1. PreE2 et E1 s’associent dans le Golgi et sont exportés vers la membrane plasmique, où pE2 est clivé en E2 et E3. La liaison de la nucléocapside virale à l’ARN viral et le recrutement des glycoprotéines d’enveloppe associées à la membrane favorisent l’assemblage viral., La particule d’alphavirus Assemblée, avec un noyau icosaédrique, bourgeonne à la membrane cellulaire.5,7
Vecteurs, transmission et réservoirs
deux cycles de transmission distincts ont été bien documentés: enzootique et urbain. En Afrique, un cycle enzootique se produit dans les habitats forestiers où les moustiques arboricoles, principalement Aedes spp, servent de vecteurs. Les preuves indiquent que les primates non humains sont les principaux réservoirs et hôtes d’amplification dans le cycle enzootique en fonction de leurs taux élevés de séroprévalence, de l’infection et de la virémie documentées dans la nature et des niveaux de virémie en réponse à une infection expérimentale.,8
le cycle de transmission enzootique peut déborder pour infecter les personnes qui vivent à proximité, et les moustiques vecteurs enzootiques peuvent être impliqués dans la transmission interhumaine lors de petites épidémies. Des épidémies se produisent également en Afrique lorsque le CHIKV est introduit dans des zones urbaines où les vecteurs les plus anthropophiles, Aedes aegypti et Aedes albopictus, peuvent initier une transmission homme–moustique–homme.
Le CHIKV est capable d’initier un cycle de transmission urbain soutenu qui repose uniquement sur A. aegypti et / ou A. albopictus et des hôtes d’amplification humains.,9 ce cycle endémique / épidémique entraîne des niveaux élevés d’exposition humaine à la transmission des moustiques, en particulier parce que ces vecteurs vivent à proximité des personnes.
le comportement et l’écologie d’A. aegypti, en particulier, sont idéaux pour la transmission épidémique car les femelles adultes préfèrent se nourrir des humains, prennent souvent plusieurs repas sanguins partiels au cours d’un seul cycle gonotrophique, oviposent dans des conteneurs artificiels comme sites larvaires préférés et se reposent à l’intérieur de maisons avec un accès10
A., albopictus est à la fois zoophile et anthropophile, agressif, silencieux, actif toute la journée et a une durée de vie plus longue que les autres moustiques (jusqu’à 8 semaines). Au cours des dernières décennies, il s’est étendu à plusieurs zones auparavant connues pour être exemptes d’Aedes.11,12 il semble que la plupart des nouvelles introductions d’A. albopictus aient été causées par des œufs végétatifs contenus dans le bois et les pneus exportés d’Asie à travers le monde.13
bien que l’infectiosité de diverses souches de CHIKV varie considérablement pour A. aegypti et A., albopictus, les humains développent des virémies à haut titre qui persistent généralement pendant les 4 premiers jours après l’apparition des symptômes, avec un pic estimé le jour de l’apparition à environ 109 Arnacopies virales/ml14 et des titres infectieux dépassant parfois 107PFU/ml.15 ces titres dépassent généralement les niveaux de dose infectieuse orale de 50% pour les deux espèces vecteurs épidémiques, ce qui permet une transmission efficace entre les humains par les moustiques.16
les êtres humains constituent le principal réservoir du CHIKV pendant les périodes épidémiques., En dehors de ces périodes, les singes, les rongeurs et les oiseaux constituent le réservoir de virus soutenant la circulation du virus dans l’environnement en l’absence de cas humains.17,18
répartition géographique
le CHIKV se transmet généralement en Afrique et en Asie du sud-est. Depuis sa découverte en 1952, le CHIKV a provoqué plusieurs épidémies dans ces endroits.19,20
la dernière grande épidémie a commencé au Kenya en 2004 et s’est propagée à travers les îles voisines jusqu’à la Réunion en 2005.21 après cela, le virus s’est propagé à plusieurs îles de l’Océan Indien et en Inde.,1,22 de L’Inde il s’est propagé au Sri Lanka, en Thaïlande,en Malaisie et enfin en Italie en 2007.23, 24 en 2009 la transmission du CHIKV a redémarré à la Réunion et a conduit à la réimportation du CHIKV en Europe en mai 2010.25
en 2011, le CHIKV a été transmis en Océanie, en Afrique centrale, en Asie du Sud et du sud-est, en Europe et dans les îles occidentales de l’Océan Indien. En 2012, le CHIKV a été signalé en Asie du Sud-Est, du Sud et de l’Ouest, en Océanie, en Afrique centrale et de l’Ouest et dans les îles de l’Océan Indien occidental. En 2013, le CHIKV a été transmis en Asie du Sud-Est, du Sud et de l’Est et en Océanie.,20
l’épidémie actuelle a commencé dans L’île des Caraïbes, Saint Martin, le 6 décembre 2013.26 en décembre 2013 et janvier 2014, elle s’est propagée aux îles voisines.27 en février, il a continué à se propager et a atteint la Guyane française.28 en mai, la Guyane et presque toutes les îles des Caraïbes ont signalé des infections autochtones au CHIKV.29 en juin, les premiers cas D’El Salvador ont été signalés.30 en juillet, une transmission autochtone a été signalée en Floride, aux États-Unis, au Costa Rica, au Panama et au Venezuela.31 en septembre, des cas avaient été signalés au Guatemala, en Colombie et au Brésil.,32 en octobre, Le Nicaragua et le Paraguay ont signalé pour la première fois des cas et le Guatemala a enregistré une augmentation.33 à la fin du mois de novembre, le Mexique a signalé sa première transmission autochtone dans l’État méridional du Chiapas. Ce mois-ci également, le Belize et Le Honduras ont signalé des cas.34
selon L’Organisation panaméricaine de la santé (Ops), depuis le début de l’épidémie actuelle, il y a eu 1 280 953 cas suspects de transmission autochtone et plus de 26 300 ont été confirmés en Amérique.35 les rapports récents obtenus du Mexique révèlent 405 transmissions autochtones confirmées.,35 néanmoins, ces chiffres n’incluent pas les patients qui n’ont pas cherché d’aide médicale.
phylogénie
Il existe quatre lignées de CHIKV identifiées, chacune ayant des caractéristiques génotypiques et antigéniques distinctes. La première étude phylogénétique a révélé que le CHIKV s’est propagé depuis l’Afrique où circulaient deux lignées majeures: L’Afrique de l’ouest et L’Afrique de l’est/Centrale/Sud (ECSA). Postérieurement, la lignée ECSA s’est propagée en Asie et est à l’origine de la lignée Asiatique.36,37 Jusqu’en 2004, ce sont les seules lignées identifiées de CHIKV qui circulaient., La source de l’épidémie de 2005 dans l’Océan Indien a été attribuée à la lignée ECSA.38 lorsque l’épidémie de L’Océan Indien a commencé au Kenya en 2004, les premiers isolats de CHIKV de l’épidémie de la Réunion ont présenté une alanine au résidu de protéine d’enveloppe E1 226, mais les isolats ultérieurs ont montré une substitution A226V. Ces substitutions et d’autres ont donné naissance à la quatrième lignée, la lignée de l’Océan Indien.38,39
pathogenèse
la pathogenèse de L’infection par le CHIKV chez l’homme est encore mal comprise, mais les récentes épidémies ont permis de mieux comprendre les cellules et les organes impliqués dans la réplication virale., Après l’inoculation intradermique par des moustiques infectés, le CHIKV pénètre directement dans les capillaires sous-cutanés et infecte les cellules sensibles de la peau: macrophages, fibroblastes et cellules endothéliales, où la réplication est limitée.40 virus produits localement sont transportés vers des organes lymphoïdes secondaires, où ils infectent les cellules migratrices et libèrent des virus dans la circulation lymphatique et se dirigent vers le sang.20 Une fois dans le sang, le virus a accès à diverses parties du corps, y compris le foie, les muscles, les articulations et le cerveau.,41 dans ces tissus, l’infection est associée à une infiltration marquée de cellules mononucléées. L’infiltration des cellules mononucléées et la réplication virale dans les muscles et les articulations sont associées à la douleur.42,43
L’infection par le CHIKV provoque de fortes réponses innées systémiques, impliquant principalement la production d’IFN-α antiviral ainsi que de nombreuses cytokines, chimiokines et facteurs de croissance pro-inflammatoires.44 ceci est suivi par l’activation de l’immunité adaptative par l’activation et la prolifération des lymphocytes T CD8+ dans les premiers stades de la maladie., Un passage classique à la réponse des lymphocytes T CD4+ et la production de protéines anti-inflammatoires IL-1ra et IL-2RA sont des caractéristiques des stades ultérieurs de la phase aiguë.44
L’infection par le CHIKV induit une forte réponse inflammatoire qui est possiblement orchestrée par la production d’il-16, D’IL-17, de la protéine chimioattractant monocytaire 1 (MCP-1), D’IP-10 et de MIP-1α. La fin de la phase aiguë est caractérisée par la production de MIF pro-inflammatoire, MIP-1β, SDF-1α, ET IL-6 et IL-8. Les taux de CCL5 (RANTES) étaient également élevés chez tous les patients au cours de la première semaine suivant l’apparition des symptômes.,44 CCL5, MCP-1, IP-10, MIP-1β et IL-8 sont produits par des macrophages activés qui sont sensibles à l’infection par le CHIKV.40 ces chimiokines jouent un rôle majeur dans le recrutement des leucocytes sur les sites d’infection, coordonnant le déploiement de défenses antivirales efficaces.
L’infection par le CHIKV induit également une forte réponse immunitaire cellulaire. Des niveaux plasmatiques élevés d’IFN-γ, D’IL-4, D’IL-7 et D’IL-12p40, des cytokines qui favorisent l’immunité adaptative, suggèrent l’implication des réponses cellulaires.,44UN rôle clé des cellules tueuses naturelles dans la clairance des cellules infectées et dans le développement de L’arthralgie du CHIKV a également été suggéré.45 les cytokines favorisant les cellules B IL – 4 et, dans certains cas, IL-10, ont également été régulées dans les premiers jours après l’apparition des symptômes, initiant probablement la production d’IgG spécifiques au CHIKV. De plus, les lymphocytes T CD4+, qui sont également impliqués dans la promotion des réponses humorales, ont été fortement activés vers la fin de la phase aiguë.,44
les anticorps IgG sont détectés dans la première semaine après l’infection, indiquant une séroconversion rapide et des niveaux élevés de réponses aux anticorps chez les personnes infectées par le CHIKV.46 IgM spécifique dure 3-4 mois à partir du début de la maladie, et cette IgG dure plus de 6 mois.47 cependant, leur rôle dans l’arthralgie chronique n’est pas très bien compris.
manifestations cliniques
la fièvre Chikungunya est caractérisée par une maladie fébrile brusque, une polyarthralgie et une éruption maculopapulaire. La période d’incubation dure 2-4 jours (rage 1-12 jours) et des infections asymptomatiques surviennent dans 5-15% des cas.,48
des études menées chez des patients infectés lors de l’éclosion à la Réunion ont montré que l’arthralgie était bilatérale et symétrique chez 78,4% des patients. Il affecté surtout les chevilles, les genoux, les mains, les poignets, les pieds, les épaules et les coudes.49-52 Éruption était présent dans 54% des patients, principalement sur le tronc et les bras. Un œdème périarticulaire a été rapporté chez 45% des patients, affectant les chevilles dans une plus grande proportion. Des myalgies et des maux de tête étaient présents chez 72 et 63% des patients, respectivement. Des signes hémorragiques tels que la gingivorragie et l’épistaxis n’étaient présents que chez 10,6% des patients.,49-52
les résultats radiologiques sont normaux et les marqueurs biologiques de l’inflammation comme la vitesse de sédimentation des érythrocytes et la protéine C-réactive sont modérément élevés.49,50,52-54 L’iridocyclite et la rétinite sont les manifestations oculaires les plus courantes associées à l’infection par le CHIKV et ont une évolution bénigne avec une résolution complète et la préservation de la vision.55
Les signes et symptômes aigus disparaissent généralement en moins de 2 semaines, mais l’arthralgie peut durer des semaines, des mois, voire des années;56,57 il s’agit d’un symptôme clinique qui peut distinguer le CHIKV de l’infection par le virus de la dengue., Toujours dans une analyse univariée, les patients infectés par le CHIKV ont présenté moins de symptômes gastro-intestinaux que les patients infectés par la dengue, et une proportion plus élevée de myalgies et d’arthralgies.58
le Chikungunya n’est généralement pas considéré comme mortel; néanmoins, des formes sévères peuvent également être présentes. Les Patients atteints de chikungunya sévère nécessitant une hospitalisation ont tendance à être plus âgés et présentent des comorbidités telles que des troubles cardiovasculaires, neurologiques et respiratoires ou le diabète, qui sont des facteurs de risque indépendants de maladie grave.,49,59 le chikungunya sévère peut se manifester par une encéphalopathie et une encéphalite, une myocardite, une hépatite et une défaillance multiorganique. Ces formes rares peuvent être fatales et surviennent généralement chez les patients présentant des conditions médicales sous-jacentes.60,61 les nouveau-nés sont également à risque d’infection grave associée à des signes neurologiques. Le taux d’infection des nouveau-nés nés de mères virémiques et exposés au virus pendant la naissance peut atteindre 50%, entraînant une maladie grave et une encéphalopathie, entraînant des séquelles neurologiques à long terme et de mauvais résultats.62
en général, l’infection par le CHIKV a un bon pronostic., Néanmoins, les patients plus âgés (63 une étude a montré que les sujets qui présentaient une atteinte rhumatismale initiale sévère (six sites douloureux ou plus avec au moins quatre autres symptômes) au stade aigu de l’infection étaient plus susceptibles de présenter des douleurs musculo-squelettiques rhumatismales chroniques lors du suivi.63 de plus, une association positive entre des titres élevés d’IgG spécifiques au CHIKV en phase de plateau et une arthralgie de longue durée a été observée simultanément à partir d’une étude pilote et dans la cohorte italienne.,63,64 une hypothèse mécaniste possible pourrait être qu’un déséquilibre vers l’expansion et la différenciation des cellules B, en réponse à la sécrétion D’IL-6 suite à la progression de l’immunosénescence65 et du chikungunya, est déclenché par la persistance virale dans les sanctuaires de l’hôte.66,67
compte tenu des caractéristiques cliniques mentionnées ci-dessus, l’algorithme présenté à la Fig. 2 guiderait le clinicien tout au long de la définition du cas et de la prise en charge. Cet algorithme est une adaptation de Palacios-Martinez.68
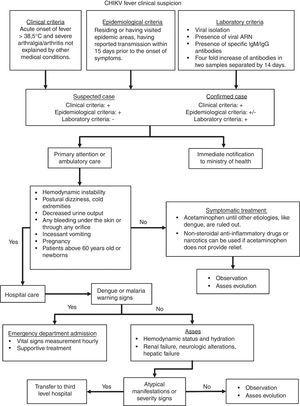
algorithme diagnostique et thérapeutique de L’infection par le CHIKV.
diagnostic
L’infection au Chikungunya est diagnostiquée sur la base de critères cliniques, épidémiologiques et de laboratoire. Un début aigu de fièvre et une arthralgie ou une arthrite sévère qui ne s’expliquent pas par d’autres troubles médicaux est considéré comme un cas possible de CHIKV.,20trois principaux types de tests de laboratoire sont utilisés pour diagnostiquer l’infection par le CHIKV: isolement du virus, réaction en chaîne inverse de la transcriptase-polymérase (RT-PCR) et sérologie.
l’isolement du Virus peut être effectué sur des moustiques prélevés sur le terrain ou sur des échantillons sériques aigus (≤8 jours). Le sérum obtenu à partir de sang total prélevé au cours de la première semaine de la maladie peut être inoculé dans une lignée cellulaire sensible ou une souris allaitante dans un laboratoire de référence. Cela peut être réalisé si l’échantillon est transporté à froid (entre 2°C et 8°C ou de la glace carbonique) et dès que possible (dans les 48h).,69
plusieurs essais de RT-PCR pour la détection de L’ARN du CHIKV ont été publiés. Des tests en temps réel en système fermé doivent être utilisés, en raison de leur sensibilité accrue et de leur faible risque de contamination. Compte tenu de la sensibilité, L’Ops recommande l’utilisation des protocoles CHIKV RT-PCR des Centers for Disease Control and Prevention et de l’Institut Pasteur.14,70 Sérum de sang total est utilisé pour les tests PCR ainsi que l’isolement du virus.
pour le diagnostic sérologique, le sérum obtenu à partir de sang total est utilisé dans le dosage immuno-enzymatique (ELISA)., L’échantillon de sérum (ou de sang) doit être transporté à 2-8°C et ne doit pas être congelé. Le diagnostic sérologique peut être fait par la démonstration d’anticorps IgM spécifiques pour le CHIKV ou par une augmentation de quatre fois du titre D’IgG dans les échantillons aigus et convalescents.69
la détermination des IgM peut être faite par différentes techniques disponibles dans le commerce. Cependant, il faut tenir compte du fait que la meilleure sensibilité provient des techniques qui utilisent le virus complet comme antigène par rapport à celles qui utilisent des protéines recombinantes., Étant donné que les premiers kits disponibles dans le commerce ont eu de mauvais résultats, il est recommandé que les techniques internes pour IgM/IgG ELISA soient mises en œuvre en utilisant l’antigène viral purifié et en suivant les protocoles CDC.60 les tests ELISA récents ont amélioré la sensibilité et la spécificité comme le montre le tableau 1.71 l’utilisation de tests rapides n’est pas recommandée. Le deuxième échantillon pour la détermination sérologique doit être prélevé entre 1 et 2 semaines après le premier échantillon. La séroconversion peut également être détectée sous la forme d’une augmentation des IgG d’un facteur 4 ou plus entre les échantillons de sérum en phase aiguë et en phase convalescente.,69
Accuracies and sensitivities of different chikungunya fever diagnostic assays.
| Assay | Sensibility (%) | Specificity (%) | PPV (%) | NPV (%) |
|---|---|---|---|---|
| RT-PCR | 88.5 | 100 | 100 | 97.,5 |
| Standard Diagnostics Chikungunya IgM ELISA | 3.9 | 92.5 | 10 | 81.6 |
| Novatech Chikungunya IgM Capture ELISA | 76.9 | 91.9 | 100 | 97.5 |
| Novatech Chikungunya IgG Capture ELISA | 80 | 100 | 100 | 95.,6 |
PPV, positive predictive value; NPV, negative predictive value; RT-PCR, reverse transcriptase-polymerase reaction; IgM, immunoglobulin M; IgG, Immunoglobulin G; ELISA, enzyme-linked immunosorbent assay.
Treatment
There is no specific antiviral drug treatment for CHIKV infection., Un traitement symptomatique est recommandé après l’exclusion des affections plus graves telles que le paludisme, la dengue et les infections bactériennes.20,21
en cas d’infection aiguë, le traitement est symptomatique et de soutien, comprenant le repos et l’utilisation d’acétaminophène pour soulager la fièvre (
g / jour). L’utilisation d’ibuprofène, de naproxène ou d’un autre agent anti-inflammatoire non stéroïdien (AINS) pour soulager la composante arthritique de la maladie peut être utilisée lorsque l’infection par la dengue est rejetée.60 chez les patients présentant des douleurs articulaires sévères qui ne sont pas soulagées par les AINS, le tramadol ou les narcotiques (par exemple, la morphine) peuvent être conseillés.,60,61 les Patients devraient être invités à boire beaucoup de liquides pour reconstituer le liquide perdu de la transpiration, des vomissements et d’autres pertes insensibles.60,72
bien que la guérison du CHIK soit le résultat attendu, la convalescence peut être prolongée et les douleurs articulaires persistantes peuvent nécessiter une gestion de la douleur, y compris un traitement anti-inflammatoire à long terme. Le traitement spécifique pour la polyarthralgie diffuse post-CHIKV au stade chronique consiste en AINS oraux ou sujets plus un court cours de corticothérapie orale ou d’injection de corticoïdes dans l’articulation touchée., La douleur neuropathique peut être traitée avec des antidépresseurs tricycliques, des médicaments antiépileptiques ou du tramadol.73
bien qu’une étude plus ancienne ait suggéré que l’hydroxychloroquine phosphate offrait un certain bénéfice dans l’arthralgie,74 études postérieures n’ont pas confirmé son efficacité.73,75,76
chez les patients présentant des symptômes articulaires réfractaires, des thérapies alternatives telles que le méthotrexate (MTX) peuvent être évaluées. Dans une étude rétrospective réalisée à la Réunion, 54 patients sur 72 ont eu une réponse clinique positive lorsqu’ils étaient traités par MTX.,73,77 lorsque le MTX est contre-indiqué ou inefficace, des agents biologiques modulant l’immunité tels que l’étanercept, le rituximab ou le tocilizumab peuvent être utilisés.73
Il a été démontré que les patients atteints de polyarthrite rhumatoïde ont de faibles taux de vitamine D et une corrélation négative avec l’activité de la maladie.78 par conséquent, le repositionnement de la vitamine D pourrait améliorer la gravité de la maladie. Dans une étude réalisée en Inde, des patients atteints d’arthrite chronique liée au CHIKV ont été traités avec de la vitamine D et du calcium pendant cinq mois, ce qui a amélioré les douleurs articulaires et la fatigue.,79
en plus de la pharmacothérapie, les cas d’arthralgie et de raideur articulaire peuvent bénéficier d’un programme de physiothérapie graduée aux stades aigu et chronique de la maladie. Le mouvement et l’exercice léger ont tendance à améliorer la raideur matinale et la douleur, mais un exercice intense peut exacerber les symptômes.
prévention
En attendant la mise au point d’un vaccin, les seules mesures préventives efficaces consistent en une protection individuelle contre les piqûres de moustiques et la lutte antivectorielle., Le contrôle des populations de moustiques adultes et larvaires utilise le même modèle que pour la dengue et a été relativement efficace dans de nombreux pays et contextes.80 la lutte contre les moustiques est la meilleure méthode disponible pour prévenir l’infection par le CHIKV. Les sites de reproduction doivent être enlevés, détruits, fréquemment vidés et nettoyés ou traités avec des insecticides.3
pour la protection, il est conseillé de porter des vêtements qui minimisent l’exposition de la peau aux vecteurs diurnes. Les répulsifs peuvent être appliqués sur la peau exposée ou sur les vêtements en stricte conformité avec les instructions de l’étiquette du produit., Les répulsifs doivent contenir du DEET (N,N-diéthyl-3-méthylbenzamide), de L’IR3535 (ester éthylique de l’acide 3 am aminopropionique) ou de l’icaridine(acide 1-pipéridinécarboxylique, 2-(2-hydroxyéthyl)-1-méthylpropylester). Les serpentins anti-moustiques ou autres vaporisateurs d’insecticide peuvent également réduire les piqûres à l’intérieur.3
vaccins
il n’existe actuellement aucun vaccin commercial contre le CHIKV, bien que certains vaccins candidats aient été testés sur des êtres humains.,81,82
Plusieurs technologies ont été utilisées pour mettre au point des vaccins contre le CHIK, notamment des vaccins viraux inactivés, des virus vivants atténués, des chimères à alphavirus, des vaccins viraux recombinants, des vaccins à ADN consensuels, des vaccins à sous-unités recombinantes et, plus récemment, un vaccin à particules virales (VLP).
deux vaccins candidats ont terminé les essais de phase I: un vaccin recombinant vivant contre le chikungunya à base de virus de la rougeole et le vaccin VRC-CHKVLP059-00-VP, VLP., Le vaccin recombinant vivant contre le chikungunya à base de virus de la rougeole avait une bonne immunogénicité, même en présence d’une immunité contre la rougeole, était sûr et avait un profil de tolérabilité généralement acceptable.83 le vaccin VLP, VRC-CHKVLP059-00-VP, était également immunogène, sûr et bien toléré.84
fardeau économique
en Inde, l’épidémie de chikungunya en 2006 a imposé un lourd fardeau épidémiologique et une perte de productivité à la communauté. Le fardeau National du chikungunya a été estimé à 25 588 Avci perdus au cours de l’épidémie de 2006., On a constaté que l’arthralgie persistante imposait un lourd fardeau, représentant 69% du total des Avci. La perte de productivité en termes de perte de revenus a été estimée à un minimum de 6 millions USD.85 autres études réalisées en Inde ont rapporté que le fardeau pour L’Andhra Pradesh était de 6600 DALYs (coût: US 1 12,400,000). Alors que le fardeau était modéré, les coûts étaient élevés et la plupart du temps hors de la poche.86
Une étude réalisée avec des policiers militaires à la Réunion en juin 2006 a révélé que la plupart des patients symptomatiques (93.,7%) se sont plaints d’un stade chronique de la maladie, caractérisé par des douleurs articulaires ou osseuses, ou les deux, bien que l’enquête ait été effectuée 6 mois après le pic épidémique. La plupart des adultes qui travaillent sont handicapés avec une perte de mobilité, un handicap de la main et une réaction dépressive, qui peuvent durer des semaines à des mois et ont des conséquences négatives sur la santé, l’organisation sociale et l’économie dans les zones épidémiques.87,88
avec ces antécédents, si l’épidémie se propage dans tout le Mexique, les adultes qui travaillent infectés seront incapables et augmenteront le fardeau économique.,
Conclusion
l’arrivée du CHIKV en Amérique constituera un défi pour le système de santé publique et un fardeau économique important. La probabilité de transmission autochtone dans le reste du Mexique et des États-Unis est élevée en raison de l’ubiquité du vecteur. Le développement économique ne protège pas les pays contre les maladies à transmission vectorielle; les modes de vie modernes peuvent amplifier une épidémie par les voyages, le vieillissement de la population et la production de déchets solides pouvant abriter les moustiques Aedes.
Financement
aucun soutien financier n’a été fourni.
Conflit d’intérêts
Les auteurs n’ont aucun conflit d’intérêts à déclarer.