Obiettivi formativi
Dopo aver completato questa sezione, dovresti essere in grado di
-
- scrivere un’equazione per rappresentare la formazione di un soap.
- identificare la struttura del grasso necessario per produrre un determinato sapone.
- identificare la struttura di un sapone, data la struttura del grasso da cui viene prodotto.
- descrivere il meccanismo con cui i saponi esercitano la loro azione detergente.,
- fornire una spiegazione chimica dei problemi incontrati quando i saponi carbossilati sono utilizzati in aree di acqua dura e spiegare come possono essere superati con l’uso di detergenti solfonati.
Termini chiave
Assicurati di poter definire e utilizzare nel contesto i termini chiave riportati di seguito.,
- idrofilo
- lipofilo (idrofobo)
- anfifilico
- micelle
Acidi carbossilici e sali aventi catene alchiliche più lunghe di otto carboni mostrano un comportamento insolito in acqua a causa della presenza di entrambe le regioni idrofile (CO2) e idrofobo (alchile) nella stessa molecola. Tali molecole sono definite anfifiliche (Gk. amphi = entrambi ) o anfipatico. Gli acidi grassi costituiti da dieci o più atomi di carbonio sono quasi insolubili in acqua e, a causa della loro densità inferiore, galleggiano sulla superficie quando mescolati con acqua., A differenza della paraffina o di altri alcani, che tendono a pozzanghere sulla superficie delle acque, questi acidi grassi si distribuiscono uniformemente su una superficie estesa dell’acqua, formando infine uno strato monomolecolare in cui i gruppi carbossilici polari sono legati all’idrogeno all’interfaccia dell’acqua e le catene di idrocarburi sono allineate insieme lontano dall’acqua. Questo comportamento è illustrato nel diagramma a destra. Le sostanze che si accumulano sulle superfici dell’acqua e modificano le proprietà superficiali sono chiamate tensioattivi.,
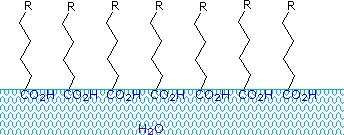
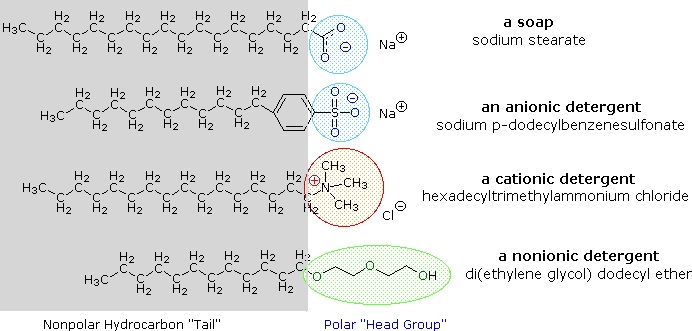
I sali di metalli alcalini degli acidi grassi sono più solubili in acqua rispetto agli acidi stessi e il carattere anfifilico di queste sostanze li rende anche tensioattivi forti. Gli esempi più comuni di tali composti sono saponi e detergenti, quattro dei quali sono mostrati di seguito. Si noti che ciascuna di queste molecole ha una catena idrocarburica non polare, la” coda “e un”gruppo di testa” polare (spesso ionico)., L’uso di tali composti come detergenti è facilitato dal loro carattere tensioattivo, che abbassa la tensione superficiale dell’acqua, permettendole di penetrare e bagnare una varietà di materiali.
Molto piccole quantità di questi tensioattivi si dissolvono in acqua per dare una dispersione casuale di molecole di soluto. Tuttavia, quando la concentrazione aumenta si verifica un cambiamento interessante. Le molecole di tensioattivo si assemblano reversibilmente in aggregati polimolecolari chiamati micelle., Raccogliendo le catene idrofobiche insieme al centro della micella, la rottura della struttura legata all’idrogeno dell’acqua liquida viene ridotta al minimo e i gruppi di teste polari si estendono nell’acqua circostante dove partecipano al legame dell’idrogeno. Queste micelle sono spesso di forma sferica, ma possono anche assumere forme cilindriche e ramificate, come illustrato a destra. Qui il gruppo di testa polare è designato da un cerchio blu e la coda non polare è una linea nera a zig-zag.
Il più antico detergente anfifilico noto all’uomo è il sapone., Il sapone è prodotto dall’idrolisi catalizzata dalla base (saponificazione) del grasso animale (vedi sotto). Prima che l’idrossido di sodio fosse disponibile in commercio, veniva utilizzata una soluzione bollente di carbonato di potassio lisciviato dalle ceneri di legno. I saponi molli del potassio poi sono stati convertiti ai saponi più duri del sodio lavando con la soluzione salina. L’importanza del sapone per la civiltà umana è documentata dalla storia, ma alcuni problemi associati al suo uso sono stati riconosciuti. Uno di questi è causato dalla debole acidità (pKa ca. 4.9) degli acidi grassi., Le soluzioni di saponi di metalli alcalini sono leggermente alcaline (pH da 8 a 9) a causa dell’idrolisi. Se il pH di una soluzione di sapone viene abbassato da contaminanti acidi, gli acidi grassi insolubili precipitano e formano una schiuma. Un secondo problema è causato dalla presenza di sali di calcio e magnesio nell’approvvigionamento idrico (acqua dura). Questi cationi bivalenti causano l’aggregazione delle micelle, che poi si depositano come una feccia sporca.
Questi problemi sono stati alleviati dallo sviluppo di anfifili sintetici chiamati detergenti (o syndets)., Usando un acido molto più forte per il gruppo di testa polare, le soluzioni acquose dell’anfifile sono meno sensibili ai cambiamenti di pH. Anche le funzioni di solfonato utilizzate per quasi tutti i detergenti anionici conferiscono maggiore solubilità alle micelle che incorporano i cationi alcalino terrosi presenti nell’acqua dura. Variazioni sul tema anfifile hanno portato allo sviluppo di altre classi, come i detergenti cationici e non ionici mostrati sopra. I detergenti cationici presentano spesso proprietà germicide e la loro capacità di modificare il pH superficiale li ha resi utili come ammorbidenti e balsami per capelli., Questi versatili chimica “strumenti” hanno radicalmente trasformato l’igiene personale e della casa prodotti per la pulizia dei mercati negli ultimi cinquant’anni
Reazioni Chimiche di Oli e Grassi
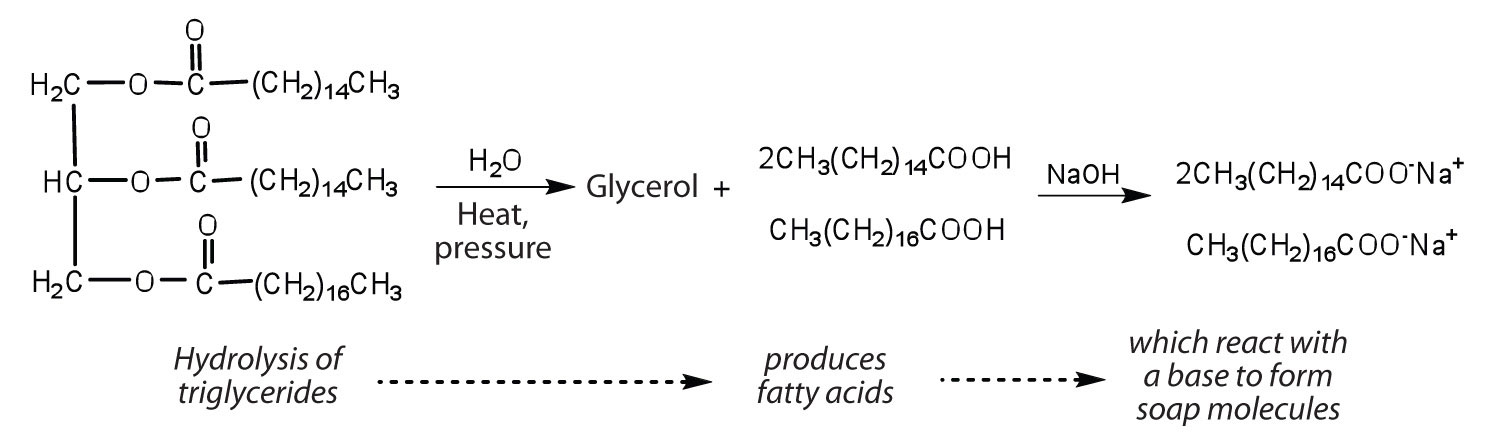
i Grassi e gli oli possono partecipare a una serie di reazioni chimiche—per esempio, perché i trigliceridi sono esteri, possono essere idrolizzato in presenza di un acido, una base, o di specifici enzimi noti come lipasi. L’idrolisi di grassi e oli in presenza di una base viene utilizzata per fare il sapone e si chiama saponificazione., Oggi la maggior parte dei saponi sono preparati attraverso l’idrolisi dei trigliceridi (spesso da sego, olio di cocco, o entrambi) utilizzando acqua ad alta pressione e temperatura . Carbonato di sodio o idrossido di sodio viene quindi utilizzato per convertire gli acidi grassi per la loro sali di sodio (sapone molecole):
Collaboratori e Attribuzioni
-
Dr. Dietmar Kennepohl FCIC (Professore di Chimica, Athabasca University)
-
il Prof. Steven Agricoltore (Sonoma State University)
-
William Reusch, Professore Emerito (dello Stato del Michigan, U.,), Libro di testo virtuale di chimica organica
- Le basi della chimica generale, organica e biologica di David W. Ball, John W. Hill e Rhonda J. Scott.