Normale fisiologia dell’aldosterone
L’aldosterone partecipa all’omeostasi del volume ematico circolante e della concentrazione di potassio sierico; questi, a loro volta, si alimentano per regolare la secrezione di aldosterone dalla zona glomerulosa della corteccia surrenale. La secrezione di aldosterone è stimolata da una deplezione effettiva o apparente del volume del sangue rilevata dai recettori di stiramento e da un aumento delle concentrazioni sieriche di ioni di potassio; è soppressa dall’ipervolemia e dall’ipopotassiemia.,
I meccanismi che regolano la secrezione di aldosterone sono complessi, coinvolgendo la zona glomerulosa delle ghiandole surrenali, l’apparato juxtaglomerulare nei reni, il sistema cardiovascolare, il sistema nervoso autonomo, i polmoni e il fegato (vedi l’immagine sotto). I principali fattori che stimolano la produzione e il rilascio di aldosterone da parte della zona glomerulosa sono l ‘ angiotensina II e la concentrazione sierica di potassio. L’apparato juxtaglomerulare è il principale sito di regolazione della produzione di angiotensina II.,
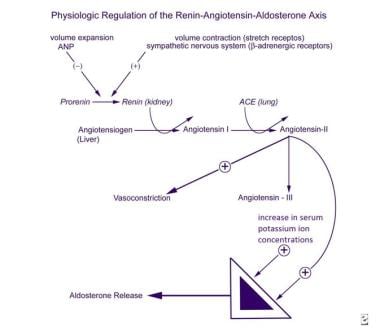 Regolazione fisiologica dell’asse renina-angiotensina-aldosterone.
Regolazione fisiologica dell’asse renina-angiotensina-aldosterone. L’ACTH stimola la secrezione di aldosterone in modo acuto e transitorio, ma non sembra svolgere un ruolo significativo nella regolazione a lungo termine della secrezione di mineralcorticoidi. I principali inibitori della zona glomerulosa includono il peptide natriuretico atriale circolante (ANP) e, localmente, la dopamina., Sebbene i livelli di ANP siano chiaramente aumentati nell’iperaldosteronismo, né l’ANP né la dopamina sono state implicate come causa primaria della secrezione di aldosterone clinicamente disordinata.
La metoclopramide ha dimostrato di aumentare la secrezione di aldosterone, suggerendo che la dopamina può inibire tonicamente il rilascio di aldosterone. I ruoli fisiologici dell’adrenomedullina e del peptide intestinale vasoattivo (VIP) sulla secrezione di aldosterone rimangono da chiarire, sebbene entrambi questi neuropeptidi siano prodotti nella zona glomerulosa del ratto.,
La sintesi della prorenina, la sua conversione in renina e la sua secrezione sistemica sono stimolate dalla contrazione del volume del sangue rilevata dai recettori stretch, dalla stimolazione beta-adrenergica del sistema nervoso simpatico e dalle prostaglandine I2 ed E2. Questi processi sono inibiti dall’espansione del volume e dall’ANP.
La renina converte l’angiotensinogeno, un proenzima sintetizzato nel fegato, nel decapeptide angiotensina I, che viene poi convertito nei polmoni nell’octapeptide angiotensina II dall’enzima di conversione dell’angiotensina (ACE)., L’angiotensina II è sia uno stimolatore della secrezione di aldosterone che un potente vasopressore. L’angiotensina II viene metabolizzata in angiotensina III, un eptapeptide che è anche uno stimolatore della secrezione di aldosterone.
La sintesi e la secrezione delle prostaglandine I2 ed E2 e la normale funzione dei recettori di stiramento dipendono dalla concentrazione di calcio ionizzato intracellulare. La secrezione renale di prostaglandine è stimolata dalle catecolamine e dall’angiotensina II., La complessa regolazione della sintesi e della secrezione di aldosterone fornisce diversi punti in cui possono verificarsi disturbi nella regolazione della secrezione di aldosterone.
L’aldosterone è sintetizzato dal colesterolo in una serie di 6 passaggi biosintetici (vedere l’immagine sotto). Solo gli ultimi 2 passaggi sono specifici per la sintesi di aldosterone; i primi 4 si applicano anche alla sintesi di cortisolo da parte della zona fasciculata. Di conseguenza, un difetto in uno degli specifici enzimi sintetici dell’aldosterone non porta all’ipercortisolismo e all’iperplasia surrenalica secondaria mediata dall’ACTH.,
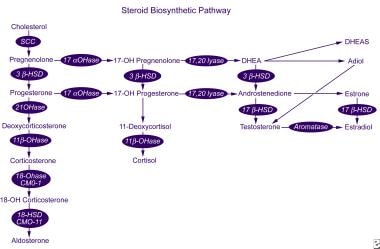 Via biosintetica steroidea.
Via biosintetica steroidea. L’enzima aldosterone sintasi è codificato dal gene CYP11B2 e ha attività 11β-idrossilasi, 18-idrossilasi e 18-idrossideidrogenasi. Questo gene si trova sul braccio cromosomico umano 8q24.3-tel, vicino al gene CYP11B1, che codifica 11β-idrossilasi, l’enzima che catalizza la fase finale della sintesi del cortisolo. Le mutazioni in questi geni possono provocare una serie di disordini della sintesi dell’aldosterone (vedi Differenziali).,
L’azione dell’aldosterone sui tessuti bersaglio (ad esempio, il tubulo renale distale, le ghiandole sudoripare, le ghiandole salivari e l’epitelio dell’intestino crasso) è mediata da uno specifico recettore mineralcorticoide. I ricevitori del mineralcorticoide esibiscono l’affinità uguale per i mineralcorticoidi ed il cortisolo, eppure i ricevitori dell’aldosterone nel tubulo distale ed altrove sono protetti dall’attivazione cortisolo-mediata dal tipo 2 della deidrogenasi 11β-hydroxysteroid, che localmente converte il cortisolo in cortisone inattivo.,
Aldosteronismo primario
Il termine iperaldosteronismo primario (o aldosteronismo primario ) si riferisce ad un aumento indipendente dalla renina della secrezione di aldosterone. Questa condizione è principalmente una malattia dell’età adulta, con il suo picco di incidenza nella quarta-sesta decade di vita.
Più del 90% dei casi di PA sono dovuti a un adenoma che produce aldosterone (APA), che rappresenta circa il 35% dei casi (30-40%), o all’iperaldosteronismo idiopatico (IHA), che rappresenta circa il 60% dei casi (quasi tutti bilaterali)., L’iperplasia surrenalica unilaterale (UAH) è una causa rara di PA, che rappresenta l ‘ 1-2% dei casi. Circa l ‘ 1% dei pazienti presenta carcinomi adrenocorticali che sono puramente aldosterone-secernenti e sono di solito grandi al momento della diagnosi; 1% presente con iperaldosteronismo familiare e 1% presente con un adenoma o carcinoma ectopico che produce aldosterone.
L’iperplasia surrenalica unilaterale rappresenta il 14-17% di tutti i casi di PA unilaterale. La prevalenza di adenoma corticale all’interno dell’iperplasia corticale è stimata al 6-24%., La presentazione clinica e l’esito dei pazienti con iperaldosteronismo primario unilaterale sono simili indipendentemente dalla diagnosi istopatologica. L’iperplasia adrenocorticale unilaterale è rara.
Gli APA (a volte indicati come aldosteronomas) sono di solito adenomi incapsulati benigni di diametro inferiore a 2 cm. La maggior parte dei casi sono solitari, anche se in ben un terzo dei casi, esistono prove di nodularità nella stessa ghiandola surrenale, suggerendo che la condizione è sorta in una ghiandola precedentemente iperplastica.,
I pazienti con IHA hanno ispessimento bilaterale e nodularità variabile della loro corteccia surrenale. Esiste un ampio spettro di gravità per questo disturbo, che può passare inosservato per lunghi periodi senza ipopotassiemia e solo ipertensione lieve. È stato suggerito che l’IHA si presenti come risultato di un fattore stimolante la corteccia surrenale non rilevato. In alternativa, il disturbo può insorgere a seguito di una mutazione attivante in un gene specifico della corteccia surrenale. Nessuna delle due ipotesi è stata dimostrata.,
Le forme ereditarie di iperaldosteronismo primario rappresentano solo l ‘ 1% dei casi, ma hanno maggiori probabilità di verificarsi durante gli anni dell’infanzia. Queste forme includono iperaldosteronismo familiare (FH) di tipo I, II, e III.
iperaldosteronismo Familiare di tipo I,
FH tipo I (FH-ho), noto anche come glucocorticoidi-sanabile iperaldosteronismo (GRA), possono essere rilevati in soggetti asintomatici durante la selezione della prole delle persone affette, o i pazienti possono presentare in tenera età, l’ipertensione, debolezza, e il fallimento di prosperare a causa di ipokaliemia., FH-I è ereditato in modo autosomico dominante e ha una bassa frequenza di nuove mutazioni.
La prima descrizione clinica del GRA apparve nel 1966 e il meccanismo genetico fu scoperto nel 1992. FH-I si presenta come conseguenza dell’incrocio disuguale sopra del CYP11B1 altamente relativo (il gene 11β-hydroxylase) e del CYP11B2 (il gene synthase dell’aldosterone) durante la meiosi, producendo un prodotto di fusione anti-Lepore tipo., Questo riarrangiamento genetico fa sì che l’espressione del CYP11B2 sia posta sotto il controllo del promotore del CYP11B1 e che la sintesi dell’aldosterone sia regolata in modo anomalo dall’ACTH anziché dal sistema renina-angiotensina.
Il risultato è la produzione di aldosterone ACTH-dipendente e la produzione di analoghi 17-idrossilati di 18-idrossicortisolo sotto regolazione ACTH dall’espressione enzimatica ectopica nella zona fasciculata. Si verifica iperplasia bilaterale della zona fasciculata e alti livelli di nuovi 18-idrossisteroidi appaiono nelle urine., La formazione di adenoma è rara, ma i pazienti hanno un aumento significativo dell’incidenza di aneurismi cerebrovascolari, per i quali richiedono uno screening.
iperaldosteronismo Familiare di tipo II
FH tipo II (FH-II) è un non–glucocorticoidi-suppressible forma ereditaria di iperaldosteronismo che è stata riconosciuta come entità distinta da Gordon et al, anche se i casi precedentemente descritti nel 1980. Come FH-ho, è ereditata in maniera autosomica dominante. In contrasto con FH-I, alcuni generi FH-II presentano un alto tasso di formazione di adenoma.,
Il meccanismo e il locus genico non sono ancora stati identificati, sebbene il CYP11B e i geni recettoriali della renina e dell’angiotensina II siano stati esclusi. Tuttavia, il collegamento è stato stabilito per un certo numero di famiglie a banda 7p22. È stato anche ipotizzato che l’FH-II non sia un singolo disturbo.
L’iperaldosteronismo familiare di tipo III
FH-III è una rara forma autosomica dominante di PA caratterizzata da ipertensione ad esordio precoce, iperaldosteronismo nonglucocorticoide riparabile e ipopotassiemia., Mutazioni missense eterozigote germinali del gene KCNJ5, codificante Kir3. 4, un membro della famiglia di canali K+ rettificanti interiormente, sono state identificate come causa di FH-III.Finora, 4 mutazioni (G151R, G151E, T158A e I157S) sono state riportate in 6 famiglie.
Il fenotipo clinico dei pazienti che ospitano le mutazioni di cui sopra varia da PA grave e ipertensione refrattaria a trattamenti medici che richiedono adrenalectomia bilaterale, a ipertensione lieve o moderata sensibile alla terapia medica. In alcuni pazienti è stata descritta iperplasia surrenalica.,
Vari studi di diversi centri riportano una prevalenza di mutazioni somatiche di KCNJ5 in APA sporadici che vanno dal 30 al 65%. Ci sono 2 mutazioni ricorrenti, G151R e L168R, riportate da tutti gli studi, mentre c’è una relazione di una delezione a 3 nucleotidi, il delI157.
I residui interessati sia della linea germinale che delle mutazioni somatiche sono dentro o vicino al filtro di selettività del canale del potassio Kir3.4 e sono altamente conservati tra diverse specie., Studi elettrofisiologici dimostrano che queste mutazioni provocano una perdita di selettività del canale, con un aumento della conduttanza Na + che porta alla depolarizzazione della membrana. Nelle cellule della zona glomerulosa, la depolarizzazione della membrana porta all’apertura dei canali Ca2+ attivati in tensione, con l’attivazione della via di segnalazione del calcio, il principale mediatore della produzione di aldosterone.
Gli APA con mutazioni KCNJ5 sono più diffusi nelle femmine rispetto ai maschi e nei pazienti più giovani. Sono anche associati a livelli di aldosterone preoperatorio più elevati., Non sono correlati con la dimensione del tumore, ma sono correlati con livelli più elevati di aldosterone e concentrazioni più basse di K+.
Le analisi del trascrittoma e della reazione a catena della polimerasi (PCR) in tempo reale dimostrano che gli APA con mutazioni KCNJ5 mostrano una maggiore espressione del gene CYP11B2 e del suo regolatore trascrizionale NR4A2, aumentando così la produzione di aldosterone. È stato anche scoperto che gli APA con e senza mutazioni KCNJ5 mostrano modelli di espressione genica leggermente diversi., Un altro studio riporta livelli di mRNA KCNJ5 più alti negli APAs con mutazioni KCNJ5 e significativamente più alti nell’APA rispetto agli adenomi e ai feocromocitomi produttori di cortisolo.
Mutazioni somatiche in ATP1A1 (gene che codifica la subunità alfa-1 della Na+ / K+ ATPasi, un membro della famiglia di ATPasi di tipo P), ATP2B3 (gene che codifica il calcio della membrana plasmatica che trasporta l’ATPasi 3 , un altro membro della famiglia di ATPasi di tipo P), o CACNA1D (gene che codifica Cav1.,3, la subunità alfa di un canale del calcio voltaggio-dipendente di tipo L) sono presenti in circa il 6%, l ‘1% e l’ 8% di tutti i casi di un adenoma che produce aldosterone, rispettivamente. Più recentemente, mutazioni germinali de novo in CACNA1D sono state riportate in 2 bambini con una sindrome precedentemente non descritta che presentava PA e anomalie neuromuscolari.,
Iperaldosteronismo secondario
L’iperaldosteronismo secondario è un termine collettivo per un gruppo eterogeneo di disturbi caratterizzati dall’attivazione fisiologica dell’asse renina-angiotensina-aldosterone (R-A-A) come meccanismo omeostatico progettato per mantenere le concentrazioni di elettroliti sierici o il volume del fluido. In presenza di normale funzionalità renale, può portare a ipopotassiemia.
L’iperaldosteronismo secondario può essere suddiviso in 2 categorie, 1 con ipertensione associata e 1 senza., La prima categoria comprende l’ipertensione renovascolare, che deriva dall’ischemia renale e dall’ipoperfusione che porta all’attivazione dell’asse R-A-A. Le cause più comuni di stenosi dell’arteria renale nei bambini sono l’iperplasia fibromuscolare e la neurofibromatosi. L’ipopotassiemia può verificarsi in ben il 20% dei pazienti.
I livelli di attività della renina plasmatica (PRA) sono spesso nell’intervallo di riferimento, ma livelli elevati di PRA possono essere rilevati dopo provocazione con una singola dose di captopril 1 mg / kg., Si pensa anche che l’ischemia renale sia alla base dell’iperaldosteronismo secondario osservato nell’ipertensione maligna.
Iperreninemia e aldosteronismo secondario sono stati riportati anche in pazienti con feocromocitoma, apparentemente a seguito di stenosi funzionale dell’arteria renale. I tumori che producono renina sono molto rari e si notano livelli molto elevati di PRA (fino a 50 ng/mL/h), spesso con un aumento del rapporto prorenina-renina. I tumori sono generalmente di origine renale e comprendono tumori di Wilms e carcinomi a cellule renali.,
L’iperkaliemia dovuta a insufficienza renale cronica causa anche iperaldosteronismo secondario. Bassi rapporti sodio-potassio possono essere misurati nella saliva e nelle feci. L’ipertensione indotta da ciclosporina nei pazienti con trapianto di organi solidi può anche comportare un componente dell’iperaldosteronismo.
L’iperaldosteronismo secondario in assenza di ipertensione si verifica a seguito di tentativi omeostatici di mantenere la concentrazione di sodio o il volume circolatorio o di ridurre la concentrazione di potassio., Le condizioni cliniche in cui può insorgere includono diarrea, sudorazione eccessiva, bassi stati di gittata cardiaca e ipoalbuminemia a causa di malattie epatiche o renali o sindrome nefrosica. Iperaldosteronismo secondario può verificarsi anche in via di sviluppo nei neonati (vedi sotto).
Aumento della dipendenza da mineralcorticoidi nei giovani
La dipendenza da mineralcorticoidi del riassorbimento di sodio aumenta durante l’infanzia e l’infanzia, con un picco nel periodo neonatale prima di diminuire progressivamente con l’avanzare dell’età., Questo aumento si verifica perché il riassorbimento di sodio e acqua da parte del tubulo prossimale è meno efficiente nei primi anni di vita, con conseguente aumento del carico di sodio e acqua a livello del tubulo renale distale.
Poiché il riassorbimento di sodio e acqua dal tubulo distale è mediato dall’asse R-A-A, il PRA è circa 10 volte a 20 volte più alto in un neonato che in un adulto., Di conseguenza, i neonati mostrano aumenti relativi dei tassi di produzione di aldosterone (>300 µg/m2/die vs 50 µg/m2/die in un adulto) e delle concentrazioni plasmatiche di aldosterone (80 pg/dL vs 16 pg/dL). Questi aumenti nei primi anni di vita spiegano perché i neonati presentano profondi sintomi clinici di iperaldosteronismo che migliorano gradualmente con l’avanzare dell’età.