Al riscaldamento, i liquidi si espandono poiché le molecole si muovono con maggiore energia superando l’attrazione intermolecolare. Al contrario, i liquidi di solito si contraggono al raffreddamento. È perché le molecole si muovono più lentamente e non sono in grado di superare la forza di attrazione tra di loro. Quando si congelano, si contraggono un po ‘ di più per formare una struttura solida rigida con spazi intermolecolari minimi tra di loro. Ma questo non è il caso dell’acqua. Invece di contrarsi, si espande.,
Il punto di vista molecolare
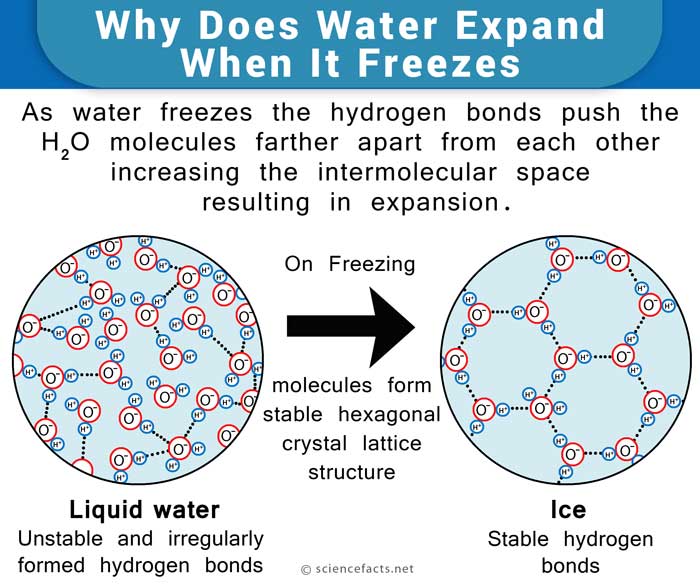
La molecola d’acqua, composta da 2 atomi di idrogeno e uno di ossigeno forma una struttura simile alla testa di Topolino tale che le orecchie sono gli atomi di idrogeno e la testa è rappresentata dall’atomo di ossigeno. Il lato dell’atomo di ossigeno della molecola è leggermente negativo mentre il lato degli atomi di idrogeno ha una leggera carica positiva. Ciò rende le molecole d’acqua disegnate l’una verso l’altra formando legami idrogeno. Al congelamento, le molecole si stabiliscono in una disposizione molto aperta in natura e contiene più spazio dell’acqua allo stato liquido., Quindi, si dice che l’acqua si espanda al congelamento e diventa meno densa. D’altra parte, si contrae sullo scongelamento, molto diverso dalla maggior parte degli altri liquidi.