Tendenze periodiche
Introduzione
Gli elettroni sono trattenuti in un atomo o ion dall’attrazione elettrostatica tra il nucleo caricato positivamente e gli elettroni caricati negativamente. Nelle specie multi-elettrone, gli elettroni non sperimentano la carica positiva completa del nucleo a causa della schermatura da parte di elettroni che si trovano tra l’elettrone di interesse e il nucleo. La quantità di carica positiva che agisce effettivamente su un elettrone è chiamata carica nucleare efficace.,
Carica nucleare efficace
Il concetto di carica nucleare efficace (Z*) è importante per comprendere le proprietà periodiche. La carica nucleare efficace è quella parte della carica nucleare totale che un dato elettrone in un atomo sperimenta. Questo è uguale al numero atomico (Z) meno la quantità (σ) che altri elettroni nell’atomo proteggono l’atomo dato dal nucleo.
Z* = Z-σ
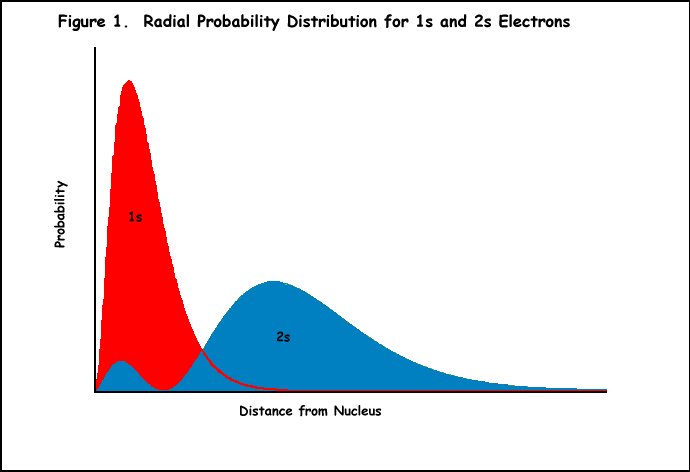
Esempio: Il litio ha tre protoni e una configurazione elettronica di 1s22s1., L’elettrone nell’orbitale 2s è protetto dalla piena attrazione dei protoni dagli elettroni dell’orbitale 1s (Figura 1). Quindi, Z * sentito dall’elettrone 2s dovrebbe essere uno piuttosto che tre. Tuttavia, l’elettrone 2s del litio non si comporta come se stesse vivendo esattamente una carica +1 (Z* è in realtà circa 1,3 unità di carica). Ciò può essere spiegato dal fatto che l’orbitale 2s ha due massimi nella sua funzione di probabilità radiale (Figura 1), e il massimo minore penetra all’interno del massimo dell’elettrone 1s interno., Sebbene l’elettrone 2s del litio passi la maggior parte del suo tempo nel lobo esterno di quell’orbitale sentendo una carica nucleare di +1, una parte del tempo è all’interno dell’orbitale 1s sperimentando la carica nucleare completa di +3. Quindi, Z * è leggermente maggiore di +1.
Le regole di Slater per determinare σ
Nel 1930, J. S. Slater formulò il seguente insieme di regole empiriche per determinare i valori della costante di schermatura σ.,
-
Scrivi la configurazione elettronica dell’elemento e raggruppa gli orbitali nel seguente ordine:
(1s)(2s, 2p)(3s, 3p)(3d)(4s, 4p)(4d)(4f)(5s, 5p)…….. - Per stabilire la costante di screening per qualsiasi elettrone, riassumere i seguenti contributi:
- Gli elettroni in gruppi esterni (a destra) a quello considerato non contribuiscono alla schermatura.
- Gli elettroni nello stesso gruppo contribuiscono 0,35 alla schermatura (tranne il gruppo 1s, dove un contributo di 0.,30 è usato
- Per gli elettroni s o p osservati, ogni elettrone nel guscio (n-1) contribuisce 0,85 alla schermatura e ogni elettrone nel (n-2), (n-3),… i gusci contribuiscono 1,00 alla schermatura
- Per gli elettroni d o f osservati, ogni elettrone in un gruppo sottostante contribuisce 1,00 alla schermatura.,
Esempio: Calcolare Z* per un 4s e un 3d di elettroni in Zn
Determinare la configurazione elettronica di Zn
(1s)2(2s, 2p)8(3s, 3p)8(3d)10(4s)2
Per un 4s elettrone:
Stabilire la proiezione costante per il 4s elettrone
σ = (1 x 0,35) + (18 x 0.85) + (10×1.00) = 25.65
Calcolare la carica nucleare efficace
Z*= Z-σ = 30-25.65 = 4.,35
Per un elettrone 3d:
Stabilire la costante di screening per l’elettrone 3d![]()
Calcolare la carica nucleare effettiva![]()
Da questo esempio, si può vedere che gli elettroni 3d sperimentano una carica positiva molto maggiore rispetto all’elettrone 4s e sarebbero tenuti più strettamente. Pertanto, gli elettroni 4s saranno i primi rimossi quando Zn è ionizzato.,
- Utilizzo di Slater regole, calcolare un valore per la carica nucleare efficace sentita da (a) un elettrone viene aggiunto al 3s orbitale di un atomo di neon e (b) un elettrone essere ionizzato dalla 2p orbitali dell’atomo di neon.
 Commenta i tuoi risultati relativi alla stabilità della configurazione elettronica dell’atomo al neon.,
Commenta i tuoi risultati relativi alla stabilità della configurazione elettronica dell’atomo al neon.,
- Calcola Z* per gli elettroni di valenza negli atomi da Li a Ne usando (a) l’ipotesi che σ sia uguale al numero di elettroni del guscio interno e (b) Le regole di Slater. Tracciare entrambe le serie di risultati sullo stesso grafico e discutere.
- Ricorda perché l’energia di un orbitale ns è inferiore a quella di un orbitale np. Usa queste informazioni per discutere l’ipotesi che questi orbitali siano sempre considerati come un gruppo (ns, np) nelle regole di Slater.
- La trama della probabilità di trovare elettroni 3s, 3p, 3d e 4s in funzione della distanza radiale dal nucleo può essere visualizzata qui., Discutere queste probabilità relative alle regole 2c e 2d delle regole di Slater.
È possibile accedere a un foglio di calcolo per il calcolo delle cariche nucleari efficaci qui. Se hai bisogno di assistenza nell’utilizzo di Excel per la stampa dei dati, prova questo tutorial.
La Tavola periodica
Hai usato la tavola periodica durante il tuo studio di chimica. Per saperne di più sulla tavola periodica qui. Mendeleev fu uno dei primi chimici a riconoscere che le proprietà degli elementi erano di natura periodica. Leggi dalla pubblicazione originale di Mendeleev.,
Tendenze periodiche
Nel resto di questo modulo, verranno analizzate le tendenze periodiche esistenti tra gli elementi. Inizia la tua indagine visualizzando questo film sulle tendenze periodiche.,
Raggio Atomico
Ci sono diversi modi per definire il raggio atomico di un atomo:
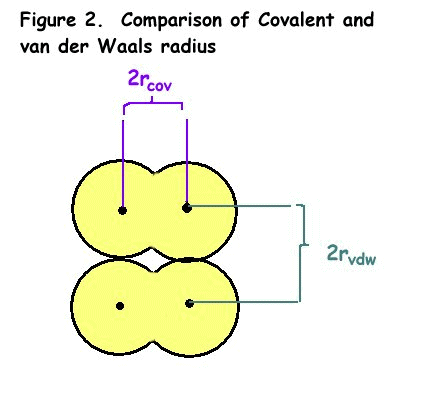
- raggio covalente (rcov), la metà della distanza tra i nuclei di due atomi uniti in un legame covalente
- raggio di van der Waals (rvdw), la metà della distanza tra i nuclei di due atomi di molecole vicine
- metallica di raggio (rmet), per elementi metallici, la metà della distanza tra i nuclei di due atomi vicini in solido metallo
La differenza tra il raggio covalente e il raggio di van der Waals è mostrato in Figura 2.,
- Tracciare i valori dei raggi rispetto al numero atomico per gli elementi del Gruppo 1A e gli elementi del Periodo 2. troverai
 i dati di cui hai bisogno in questo foglio di calcolo Excel dei dati delle proprietà fisiche per gli elementi (fare clic con il tasto destro sul link ti consentirà di salvare il file).
i dati di cui hai bisogno in questo foglio di calcolo Excel dei dati delle proprietà fisiche per gli elementi (fare clic con il tasto destro sul link ti consentirà di salvare il file).
- Utilizzare il concetto di carica nucleare efficace per razionalizzare l’andamento dei valori dei raggi per gli elementi del Gruppo 1A.,
- Utilizzare il concetto di carica nucleare efficace per razionalizzare l’andamento dei valori dei raggi per il Periodo 2 elementi.
Puoi vedere un breve filmato che descrive ciò che avresti dovuto concludere qui.
Energia di ionizzazione
Ricordiamo che l’energia di ionizzazione (in realtà la prima energia di ionizzazione) è l’energia necessaria per rimuovere un elettrone dall’orbitale occupato più esterno di un atomo gassoso.
- Tracciare le energie di ionizzazione per i primi 86 elementi della tavola periodica rispetto al numero atomico.,
 Visualizza il grafico sia come grafico normale che come grafico a barre. Spiegare le tendenze generali che si verificano in un periodo e giù una famiglia utilizzando il concetto di carica nucleare efficace. In ogni periodo si verifica un’anomalia alla tendenza generale con l’elemento del Gruppo 3A e l’elemento del Gruppo 6A. Spiega questo comportamento anomalo.
Visualizza il grafico sia come grafico normale che come grafico a barre. Spiegare le tendenze generali che si verificano in un periodo e giù una famiglia utilizzando il concetto di carica nucleare efficace. In ogni periodo si verifica un’anomalia alla tendenza generale con l’elemento del Gruppo 3A e l’elemento del Gruppo 6A. Spiega questo comportamento anomalo. - Usando le regole di Slater, calcola la Z * per Al, Al+, Al2+ e Al3+. Discutere i risultati relativi alle energie di ionizzazione previste per queste specie.,
- Calcolare la Z * per la valenza ns elettrone di litio, sodio e potassio utilizzando l’ipotesi che σ è uguale al numero di elettroni del guscio interno. I tuoi risultati sono coerenti con le tendenze nell’energia di ionizzazione per questi elementi? Discutere perché o perché no.
Affinità elettronica
Affinità elettronica è il cambiamento di energia che si verifica quando un elettrone viene aggiunto ad un atomo neutro, gassoso.
Tracciare l’affinità elettronica per gli elementi del Gruppo principale ( Gruppo 1A-8A) rispetto al numero atomico., Visualizza il grafico sia come grafico normale che come grafico a barre. Spiegare le tendenze generali che si verificano in un periodo e giù una famiglia utilizzando il concetto di carica nucleare efficace. Un’anomalia alla tendenza generale si verifica in un periodo nel passare dall’elemento del Gruppo 1A all’elemento del Gruppo 2A e nel passare dal Gruppo 4A al Gruppo 5A. Un’anomalia può anche essere trovata tra le righe 2 e 3 nel scendere un periodo. Dare una spiegazione per ciascuna di queste anomalie.,
Visualizza il grafico sia come grafico normale che come grafico a barre. Spiegare le tendenze generali che si verificano in un periodo e giù una famiglia utilizzando il concetto di carica nucleare efficace. Un’anomalia alla tendenza generale si verifica in un periodo nel passare dall’elemento del Gruppo 1A all’elemento del Gruppo 2A e nel passare dal Gruppo 4A al Gruppo 5A. Un’anomalia può anche essere trovata tra le righe 2 e 3 nel scendere un periodo. Dare una spiegazione per ciascuna di queste anomalie.,
Elettronegatività
L’elettronegatività è la capacità di un atomo in una molecola di attirare elettroni su se stesso.
 Disegna una tavola periodica, indicando l’andamento delle elettronegatività dal più basso al più alto. Correlare queste tendenze alla carica nucleare effettiva e alle dimensioni atomiche.
Disegna una tavola periodica, indicando l’andamento delle elettronegatività dal più basso al più alto. Correlare queste tendenze alla carica nucleare effettiva e alle dimensioni atomiche.
Altre tendenze
Esistono molte proprietà per le quali è possibile indagare le tendenze periodiche. C’è un bel foglio di calcolo Excel che ti permette di guardare le tendenze per le varie proprietà in 3-D., Scarica il foglio di calcolo. Questo foglio di calcolo utilizza macro per accedere ai grafici. Se viene visualizzato un messaggio che indica che le macro non sono state scaricate a causa dell’impostazione di sicurezza, reimpostare l’impostazione di sicurezza per Excel utilizzando il menu Strumenti. Sarà necessario abilitare la modifica e, se richiesto, renderlo un documento attendibile.
![]()