Introduzione
La febbre Chikungunya è una malattia virale trasmessa attraverso il morso di zanzare Aedes infette. La malattia consiste tipicamente di una malattia acuta con febbre, eruzione cutanea e artralgia invalidante. La parola chikungunya significa “camminare piegati” nel dialetto africano Makonde e si riferisce all’effetto dell’artralgia invalidante osservata nei pazienti affetti.1 Virus Chikungunya (CHIKV) è l’agente eziologico e un membro del genere Alphavirus nella famiglia Togaviridae.,2
I casi di Chikungunya si verificano in Africa, Asia e nel subcontinente indiano. Le infezioni umane in Africa sono state a livelli relativamente bassi per un certo numero di anni. Nel dicembre 2013, la Francia ha riportato 2 casi autoctoni confermati da laboratorio di nella parte francese dell’isola caraibica di San Martino. Da allora, la trasmissione locale è stata confermata in oltre 43 paesi e territori della regione americana.3 Questo è stato il primo focolaio documentato di CHIKV con trasmissione autoctona nelle Americhe; pertanto è oggetto di grande preoccupazione nel nostro continente.,
Genoma, struttura e replicazione di CHIKV
Il virus Chikungunya è un virus a RNA avvolto a più filamenti con simmetria icosaedrica. Il virione ha un diametro di 70 nm ed è composto da unità ripetute delle glicoproteine transmembrane E1 ed E2 (240 eterodimeri di E2/E1 disposti come picchi trimerici sulla sua superficie), il capside (C), un doppio strato lipidico derivato dall’ospite e una singola molecola di RNA del genoma.4 Il genoma è approssimativamente 12kb di lunghezza e codifica le proteine non strutturali (nsPs) all’estremità 5′ e le proteine strutturali all’estremità 3′., Gli NSP sono tradotti dall’RNA genomico e le proteine strutturali da un RNA sottogenomico (Fig. 1).5
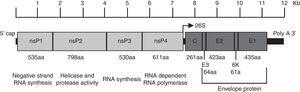
Organizzazione del genoma del virus chikungunya. La figura mostra le proteine non strutturali e strutturali il modo in cui sono organizzati in tutto il genoma, nonché le regioni non traducibili in 5′ e 3′. La funzione e la dimensione in amminoacidi è mostrata per ogni proteina. La figura è disegnata in scala in base al genoma di CHIKV con numero di accesso GenBank: AM258990., Le dimensioni delle regioni non traducibili sono state ottenute da Hyde et al.92 La figura è stata adattata da Weaver61 e Solignat.93 nsP, proteina non strutturale; C, capside; E, busta; AA, aminoacido.
Gli alfavirus entrano nelle cellule bersaglio per endocitosi. Alcuni recettori (SEGNO DC, SEGNO L, eparina solfato, laminina e integrine) sono stati implicati in questo processo, ma i loro ruoli precisi non sono stati chiaramente dimostrati.5 Recentemente, la proibitina è stata identificata come proteina del recettore CHIKV.,6 Dopo l’endocitosi, l’ambiente acido dell’endosoma innesca cambiamenti conformazionali nell’involucro virale che espongono il peptide E1, che media la fusione della membrana cellulare virus–ospite. Ciò consente la consegna citoplasmatica del nucleo e il rilascio del genoma virale. Due precursori di proteine non strutturali sono tradotti dall’mRNA virale e la scissione di questi precursori genera nsP1–nsP4.7 Queste proteine si assemblano per formare il complesso di replicazione virale, che sintetizza un intermedio di RNA a filamento negativo a lunghezza intera., Questo serve come modello per la sintesi di entrambi gli RNA subgenomici (26S) e genomici (49S). L’RNA subgenomico guida l’espressione del precursore della poliproteina C–pE2–6K–E1, che viene elaborato mediante autoprotolisi. Il capside viene rilasciato e l’ulteriore elaborazione genera le glicoproteine pE2 ed E1. PreE2 ed E1 si associano nel Golgi e vengono esportati nella membrana plasmatica, dove pE2 viene scisso in E2 ed E3. Il legame del nucleocapside virale all’RNA virale e il reclutamento delle glicoproteine dell’involucro associate alla membrana promuovono l’assemblaggio virale., La particella alphavirus assemblata, con un nucleo icosaedrico, germoglia sulla membrana cellulare.5,7
Vettori, trasmissione e serbatoi
Sono stati ben documentati due distinti cicli di trasmissione: enzootico e urbano. In Africa, un ciclo enzootico si verifica in habitat boschivi dove le zanzare arboree, principalmente Aedes spp, servono come vettori. L’evidenza indica i primati non umani come il principale serbatoio e ospite di amplificazione nel ciclo enzootico in base ai loro alti tassi di sieroprevalenza, infezione documentata e viremia in natura e livelli di viremia in risposta all’infezione sperimentale.,8
Il ciclo di trasmissione enzootica può fuoriuscire per infettare le persone che vivono nelle vicinanze e i vettori di zanzare enzootiche possono essere coinvolti nella trasmissione interumana durante piccoli focolai. Le epidemie si verificano anche in Africa quando CHIKV viene introdotto nelle aree urbane dove i vettori più antropofili, Aedes aegypti e Aedes albopictus, possono avviare la trasmissione uomo–zanzara–uomo.
CHIKV è in grado di avviare un ciclo di trasmissione urbano sostenuto che si basa solo su A. aegypti e / o A. albopictus e host di amplificazione umana.,9 Questo ciclo endemico / epidemico si traduce in alti livelli di esposizione umana alla trasmissione delle zanzare, in particolare perché questi vettori vivono in prossimità delle persone.
Il comportamento e l’ecologia di A. aegypti, in particolare, sono ideali per la trasmissione epidemica, perché le femmine adulte preferiscono nutrirsi di esseri umani, spesso diversi parziale pasti di sangue durante un singolo gonotrophic ciclo, oviposit in contenitori artificiali come il loro preferito larvale siti, e il resto all’interno delle abitazioni con accesso per ospiti umani.10
A., albopictus è sia zoofilo che antropofilo, aggressivo, silenzioso, attivo tutto il giorno e ha una durata di vita più lunga rispetto ad altre zanzare (fino a 8 settimane). Negli ultimi decenni si è espansa in diverse aree precedentemente note per essere prive di Aedes.11,12 Sembra che la maggior parte delle nuove introduzioni di A. albopictus siano state causate da uova vegetative contenute in legname e pneumatici esportati dall’Asia in tutto il mondo.13
Sebbene l’infettività di vari ceppi di CHIKV vari ampiamente sia per A. aegypti che per A., albopictus, gli esseri umani sviluppano viremia ad alto titolo che generalmente persistono durante i primi 4 giorni dopo l’insorgenza dei sintomi, con il picco stimato il giorno dell’esordio a circa 109 rnacopie virali/ml14 e titoli infettivi a volte superiori a 107PFU/ml.15 Questi titoli superano generalmente i livelli di dose infettiva orale 50% per entrambe le specie di vettori epidemici, consentendo una trasmissione efficiente tra gli esseri umani da parte delle zanzare.16
Gli esseri umani fungono da principale serbatoio di CHIKV durante i periodi epidemici., Al di fuori di questi periodi, scimmie, roditori e uccelli costituiscono il serbatoio del virus che sostiene la circolazione del virus nell’ambiente in assenza di casi umani.17,18
Distribuzione geografica
CHIKV si trova tipicamente trasmesso in Africa e nel sud-est asiatico. Dalla sua scoperta nel 1952, CHIKV ha causato diverse epidemie in questi luoghi.19,20
L’ultima grande epidemia è iniziata in Kenya nel 2004 e si è diffusa attraverso le isole vicine a La Réunion nel 2005.21 Dopo di che, il virus si è diffuso in diverse isole dell’Oceano Indiano e dell’India.,1,22 Dall’India si è diffuso in Sri Lanka, Thailandia, Malesia e infine in Italia nel 2007.23, 24 Nel 2009 La trasmissione di CHIKV è stata riavviata a La Réunion e ha portato alla reimportazione di CHIKV in Europa nel maggio 2010.25
Nel corso del 2011, CHIKV è stata trasmessa in Oceania, Africa centrale, Asia meridionale e sudorientale, Europa e Isole occidentali dell’Oceano Indiano. Nel 2012, CHIKV è stato segnalato in: Asia sud-orientale, meridionale e occidentale; Oceania; Africa centrale e occidentale; e isole dell’Oceano Indiano occidentale. Durante il 2013, CHIKV è stato trasmesso nel sud-est, Asia meridionale e orientale e Oceania.,20
L’attuale epidemia è iniziata nell’isola caraibica di Saint Martin il 6 dicembre 2013.26 Durante dicembre 2013 e gennaio 2014 si è diffusa nelle isole vicine.27 A febbraio, ha continuato a diffondersi e ha raggiunto la Guyana francese.28 A maggio, la Guiana e quasi tutte le isole dei Caraibi hanno riportato infezioni autoctone da CHIKV.29 A giugno sono stati segnalati i primi casi di El Salvador.30 A luglio, la trasmissione autoctona è stata segnalata in Florida, Stati Uniti, Costa Rica, Panama e Venezuela.31 A settembre, sono stati segnalati casi in Guatemala, Colombia e Brasile.,32 In ottobre, il Nicaragua e il Paraguay hanno segnalato casi per la prima volta e i casi guatemaltechi sono aumentati.33 Alla fine di novembre, il Messico ha segnalato la sua prima trasmissione autoctona nello stato meridionale del Chiapas. Anche da questo mese, Belize e Honduras hanno segnalato casi.34
Secondo l’Organizzazione panamericana della sanità (PAHO), dall’inizio dell’attuale epidemia, ci sono stati 1.280.953 casi sospetti di trasmissione autoctona e più di 26.300 sono stati confermati in America.35 I recenti rapporti ottenuti dal Messico rivelano 405 trasmissioni autoctone confermate.,35 Tuttavia, questi numeri non includono i pazienti che non hanno cercato assistenza medica.
Filogenesi
Ci sono quattro lignaggi CHIKV identificati, ciascuno con caratteristiche genotipiche e antigeniche distinte. Il primo studio filogenetico ha rivelato che il CHIKV si diffuse dall’Africa dove circolavano due principali lignaggi: l’Africa occidentale e l’Africa orientale/centrale/meridionale (ECSA). Posteriormente il lignaggio ECSA si diffuse in Asia e originò il lignaggio asiatico.36,37 Fino al 2004, questi erano gli unici lignaggi CHIKV identificati che circolavano., La fonte dell’epidemia dell’Oceano Indiano del 2005 è stata fatta risalire al lignaggio ECSA.38 Quando l’epidemia dell’Oceano Indiano è iniziata in Kenya 2004, i primi isolati di CHIKV dall’epidemia di La Réunion hanno mostrato un’alanina al residuo proteico della busta E1 226, ma in seguito gli isolati hanno mostrato una sostituzione A226V. Questa e altre sostituzioni diedero origine al quarto lignaggio, il lignaggio dell’Oceano Indiano.38,39
Patogenesi
La patogenesi dell’infezione da CHIKV nell’uomo è ancora poco conosciuta, ma recenti epidemie hanno contribuito a fornire informazioni sulle cellule e sugli organi coinvolti nella replicazione virale., In seguito all’inoculazione intradermica da parte di zanzare infette, CHIKV entra direttamente nei capillari sottocutanei e infetta le cellule sensibili della pelle: macrofagi, fibroblasti e cellule endoteliali, dove si verifica una replicazione limitata.40 I virus prodotti localmente vengono trasportati negli organi linfoidi secondari, dove infettano le cellule migratorie e rilasciano virus nella circolazione linfatica e procedono al sangue.20 Una volta nel sangue, il virus ha accesso a varie parti del corpo, tra cui fegato, muscoli, articolazioni e cervello.,41 In questi tessuti, l’infezione è associata a una marcata infiltrazione di cellule mononucleate. L’infiltrazione delle cellule mononucleate e la replicazione virale nei muscoli e nelle articolazioni sono associate al dolore.42,43
L’infezione da CHIKV suscita forti risposte innate sistemiche, che coinvolgono principalmente la produzione di antivirali IFN-α e molte citochine pro-infiammatorie, chemochine e fattori di crescita.44 Questo è seguito dall’attivazione dell’immunità adattativa attraverso l’attivazione e la proliferazione delle cellule T CD8+ nelle prime fasi della malattia., Un classico passaggio alla risposta delle cellule T CD4+ e la produzione di proteine antinfiammatorie IL-1RA e IL-2RA sono caratteristiche delle fasi successive della fase acuta.44
L’infezione da CHIKV induce una forte risposta infiammatoria che è probabilmente orchestrata dalla produzione di IL-16, IL-17, proteina chemoattrattante monocitaria 1 (MCP-1), IP-10 e MIP-1α. La fine della fase acuta è caratterizzata dalla produzione di MIF proinfiammatoria, MIP-1β, SDF-1α e IL-6 e IL-8. Anche i livelli di CCL5 (RANTES) erano elevati in tutti i pazienti durante la prima settimana dopo l’insorgenza dei sintomi.,44 CCL5, MCP-1, IP-10, MIP-1β e IL-8 sono prodotti da macrofagi attivati suscettibili all’infezione da CHIKV.40 Queste chemochine svolgono un ruolo importante nella recluta dei leucociti nei siti di infezione, coordinando l’implementazione di efficaci difese antivirali.
L’infezione da CHIKV induce anche una forte risposta immunitaria cellulare. Alti livelli plasmatici di IFN-γ, IL-4, IL-7 e IL-12p40, citochine che promuovono l’immunità adattativa, hanno suggerito il coinvolgimento delle risposte cellulari.,È stato anche suggerito un ruolo chiave per le cellule natural killer nella clearance delle cellule infette e nello sviluppo dell’artralgia di CHIKV.45 Le citochine IL-4 e in alcuni casi IL-10 che promuovono le cellule B, sono state anche regolate nei primi giorni dopo l’insorgenza dei sintomi, probabilmente iniziando la produzione di IgG specifiche per CHIKV. Inoltre, i linfociti T CD4+, che sono anche coinvolti nella promozione delle risposte umorali, sono stati fortemente attivati verso la fine della fase acuta.,44
Gli anticorpi IgG sono rilevati nella prima settimana dopo l’infezione, indicando una rapida sieroconversione e alti livelli di risposte anticorpali tra gli individui infetti da CHIKV.46 IgM specifico dura per 3-4 mesi dall’inizio della malattia, e che IgG dura più di 6 mesi.47 Tuttavia, il loro ruolo nell’artralgia cronica non è molto ben compreso.
Manifestazioni cliniche
La febbre di Chikungunya è caratterizzata da una brusca malattia febbrile, poliartralgia e eruzione maculopapulare. Il periodo di incubazione dura 2-4 giorni (rabbia 1-12 giorni) e le infezioni asintomatiche si verificano nel 5-15% dei casi.,
Gli studi condotti in pazienti infetti durante il focolaio di La Réunion hanno indicato che l’artralgia era bilaterale e simmetrica nel 78,4% dei pazienti. Ha colpito principalmente caviglie, ginocchia, mani, polsi, piedi, spalle e gomiti.49-52 Rash era presente nel 54% dei pazienti, prevalentemente sul tronco e sulle braccia. Edema periarticolare è stato riportato nel 45% dei pazienti, interessando le caviglie in una proporzione maggiore. Mialgia e cefalea erano presenti rispettivamente nel 72 e nel 63% dei pazienti. Segni emorragici come gengivorragia ed epistassi erano presenti solo nel 10,6% dei pazienti.,49-52
I risultati radiologici sono normali e i marcatori biologici di infiammazione come la velocità di sedimentazione degli eritrociti e la proteina C-reattiva sono moderatamente elevati.49,50,52-54 Iridociclite e retinite sono le manifestazioni oculari più comuni associate all’infezione da CHIKV e hanno un decorso benigno con completa risoluzione e conservazione della vista.55
I segni e i sintomi acuti di solito si risolvono in meno di 2 settimane, ma l’artralgia può durare per settimane, mesi o addirittura anni;56,57 questo è un sintomo clinico che può distinguere CHIKV dall’infezione da virus dengue., Anche in un’analisi univariata, i pazienti infetti da CHIKV hanno mostrato meno sintomi gastrointestinali rispetto ai pazienti infetti da dengue e una percentuale più elevata di mialgia e artralgia.58
Chikungunya non è generalmente considerata pericolosa per la vita; tuttavia possono essere presenti anche forme gravi. I pazienti con grave febbre chikungunya che richiedono il ricovero in ospedale tendono ad essere più anziani e hanno comorbidità come disturbi cardiovascolari, neurologici e respiratori o diabete, che sono fattori di rischio indipendenti per la malattia grave.,49,59 Grave chikungunya può manifestarsi come encefalopatia ed encefalite, miocardite, epatite e insufficienza multiorgano. Queste forme rare possono essere fatali e in genere si presentano in pazienti con condizioni mediche sottostanti.60,61 Neonati sono anche a rischio di infezione grave associata a segni neurologici. Il tasso di infezione dei neonati nati da madri viremiche ed esposti al virus durante la nascita può raggiungere il 50%, portando a gravi malattie ed encefalopatia, con conseguente sequele neurologiche a lungo termine e scarso esito.62
In generale, l’infezione da CHIKV ha una buona prognosi., Tuttavia, i pazienti più anziani (63 Uno studio ha mostrato che i soggetti che avevano manifestato un grave coinvolgimento reumatico iniziale (sei o più siti dolorosi con almeno altri quattro sintomi) nella fase acuta dell’infezione avevano maggiori probabilità di mostrare dolore muscolo-scheletrico reumatico cronico al follow-up.63 Inoltre, un’associazione positiva tra alti titoli di IgG CHIKV-specifici nella fase di plateau e artralgia di lunga durata è stata osservata contemporaneamente da uno studio pilota e nella coorte italiana.,63,64 Una possibile ipotesi meccanicistica potrebbe essere che uno squilibrio verso l’espansione e la differenziazione delle cellule B, in risposta alla secrezione di IL-6 in seguito alla progressione sia dell’immunosenescenza65 che di chikungunya è innescato dalla persistenza virale nei santuari ospiti.66,67
Prendendo in considerazione le caratteristiche cliniche di cui sopra, l’algoritmo presentato in Fig. 2 guiderebbe il clinico in tutta la definizione del caso, e la gestione. Questo algoritmo è un adattamento di Palacios-Martinez.68
Algoritmo diagnostico e terapeutico dell’infezione da CHIKV.
Diagnosi
L’infezione da Chikungunya viene diagnosticata sulla base di criteri clinici, epidemiologici e di laboratorio. Un esordio acuto di febbre e grave artralgia o artrite che non è spiegato da altri disturbi medici è considerato un possibile caso di CHIKV.,20tre tipi principali di test di laboratorio sono utilizzati per diagnosticare l’infezione da CHIKV: isolamento del virus, reazione a catena della trascrittasi-polimerasi inversa (RT-PCR) e sierologia.
L’isolamento del virus può essere eseguito su zanzare raccolte sul campo o campioni di siero acuto (≤8 giorni). Il siero ottenuto da sangue intero raccolto durante la prima settimana di malattia può essere inoculato in una linea cellulare sensibile o in un topo da latte presso un laboratorio di riferimento. Ciò può essere ottenuto se il campione viene trasportato a freddo (tra 2°C e 8°C o ghiaccio secco) e il più presto possibile (entro 48 ore).,69
Sono stati pubblicati diversi test RT-PCR per la rilevazione dell’RNA CHIKV. In tempo reale, devono essere utilizzati test di sistema chiuso, a causa della loro maggiore sensibilità e minor rischio di contaminazione. Tenendo conto della sensibilità, l’PAHO raccomanda l’uso dei protocolli CHIKV RT-PCR dei Centers for Disease Control and Prevention e dell’Istituto Pasteur.14,70 Siero di sangue intero viene utilizzato per il test PCR e per l’isolamento del virus.
Per la diagnosi sierologica, il siero ottenuto da sangue intero viene utilizzato nel test immunoassorbente legato all’enzima (ELISA)., Il campione di siero (o sangue) deve essere trasportato a 2-8°C e non deve essere congelato. La diagnosi sierologica può essere fatta dalla dimostrazione degli anticorpi di IgM specifici per CHIKV o da un aumento di quattro volte nel titolo di IgG nei campioni acuti e convalescenti.69
La determinazione delle IgM può essere effettuata con diverse tecniche disponibili in commercio. Tuttavia, si dovrebbe tenere conto del fatto che la migliore sensibilità proviene da tecniche che utilizzano il virus completo come antigene rispetto a quelle che utilizzano proteine ricombinanti., Poiché i primi kit disponibili in commercio hanno avuto scarsi risultati, si raccomanda di implementare tecniche interne per IgM/IgG ELISA utilizzando l’antigene virale purificato e seguendo i protocolli CDC.60 Test ELISA recenti hanno migliorato la sensibilità e la specificità come mostrato nella Tabella 1.71 L’uso di test rapidi non è raccomandato. Il secondo campione per la determinazione sierologica deve essere prelevato tra 1 e 2 settimane dopo il primo campione. La sieroconversione può anche essere rilevata come un aumento delle IgG di un fattore 4 o più tra i campioni di siero in fase acuta e in fase convalescente.,69
Accuracies and sensitivities of different chikungunya fever diagnostic assays.
| Assay | Sensibility (%) | Specificity (%) | PPV (%) | NPV (%) |
|---|---|---|---|---|
| RT-PCR | 88.5 | 100 | 100 | 97.,5 |
| Standard Diagnostics Chikungunya IgM ELISA | 3.9 | 92.5 | 10 | 81.6 |
| Novatech Chikungunya IgM Capture ELISA | 76.9 | 91.9 | 100 | 97.5 |
| Novatech Chikungunya IgG Capture ELISA | 80 | 100 | 100 | 95.,6 |
PPV, positive predictive value; NPV, negative predictive value; RT-PCR, reverse transcriptase-polymerase reaction; IgM, immunoglobulin M; IgG, Immunoglobulin G; ELISA, enzyme-linked immunosorbent assay.
Treatment
There is no specific antiviral drug treatment for CHIKV infection., Si raccomanda un trattamento sintomatico dopo aver escluso condizioni più gravi come malaria, dengue e infezioni batteriche.20,21
Nell’infezione acuta, il trattamento è sintomatico e di supporto, compreso il riposo e l’uso di paracetamolo per alleviare la febbre (
g / die). L’uso di napprofene, naprossene o un altro agente antinfiammatorio non steroideo (FANS) per alleviare la componente artritica della malattia può essere utilizzato quando l’infezione da dengue viene scartata.60 In pazienti con dolori articolari gravi che non sono alleviati da FANS, tramadolo o narcotici (ad esempio, morfina) può essere consigliato.,60,61 I pazienti devono essere consigliati di bere molti liquidi per reintegrare i liquidi persi a causa di sudorazione, vomito e altre perdite insensibili.60,72
Mentre il recupero da CHIK è il risultato atteso, la convalescenza può essere prolungata e il dolore articolare persistente può richiedere una gestione del dolore, inclusa una terapia antinfiammatoria a lungo termine. Il trattamento specifico per la poliartralgia post-CHIKV diffusa in fase cronica consiste in FANS orali o topici più un breve ciclo di cortoterapia orale o iniezione di corticoidi nell’articolazione interessata., Il dolore neuropatico può essere trattato con antidepressivi triciclici, farmaci antiepilettici o tramadolo.Sebbene uno studio più vecchio suggerisse che il fosfato di idrossiclorochina offrisse qualche beneficio nell’artralgia, 74 studi posteriori non sono riusciti a confermare la sua efficacia.73,75,76
In pazienti con sintomi articolari refrattari, possono essere valutate terapie alternative come il metotrexato (MTX). In uno studio retrospettivo condotto nell’isola di La Réunion, 54 pazienti su 72 hanno avuto una risposta clinica positiva quando trattati con MTX.,73,77 Quando MTX è controindicato o inefficace, possono essere utilizzati agenti biologici immuno-modulanti come etanercept, rituximab o tocilizumab.73
È stato dimostrato che i pazienti con artrite reumatoide hanno bassi livelli di vitamina D e una correlazione negativa con l’attività della malattia.78 Pertanto, riposizionare la vitamina D potrebbe migliorare la gravità della malattia. In uno studio realizzato in India, i pazienti con artrite cronica correlata a CHIKV sono stati trattati con vitamina D e calcio per cinque mesi, migliorando il dolore e l’affaticamento delle articolazioni.,79
Oltre alla farmacoterapia, i casi con artralgia e rigidità articolare possono beneficiare di un programma di fisioterapia graduata nelle fasi acute e croniche della malattia. Il movimento e l’esercizio lieve tendono a migliorare la rigidità mattutina e il dolore, ma l’esercizio pesante può esacerbare i sintomi.
Prevenzione
In attesa dello sviluppo del vaccino, le uniche misure preventive efficaci consistono nella protezione individuale contro le punture di zanzara e nel controllo vettoriale., Il controllo delle popolazioni di zanzare sia adulte che larvali utilizza lo stesso modello della dengue ed è stato relativamente efficace in molti paesi e contesti.80 Il controllo delle zanzare è il miglior metodo disponibile per prevenire l’infezione da CHIKV. I siti di riproduzione devono essere rimossi, distrutti, svuotati frequentemente e puliti o trattati con insetticidi.3
Per la protezione, si consiglia un abbigliamento che minimizzi l’esposizione della pelle ai vettori che mordono il giorno. I repellenti possono essere applicati sulla pelle esposta o sugli indumenti in stretta conformità con le istruzioni sull’etichetta del prodotto., I repellenti devono contenere DEET (N, N-dietil-3-metilbenzammide), IR3535 (estere etilico dell’acido 3 am aminopropionico) o icaridina(acido 1-piperidinecarbossilico, 2-(2-idrossietil)-1-metilpropilestere). Le bobine della zanzara o altri vaporizzatori dell’insetticida possono anche ridurre il morso dell’interno.3
Vaccini
Attualmente non esiste un vaccino commerciale per CHIKV, sebbene alcuni vaccini candidati siano stati testati su esseri umani.,81,82
Diverse tecnologie sono state utilizzate per sviluppare vaccini CHIK, tra cui vaccini virali inattivati, virus vivi attenuati, chimere da alfavirus, vaccini virali ricombinanti, vaccini a DNA basati sul consenso, vaccini a subunità ricombinanti e, più recentemente, un vaccino a particelle simili a virus (VLP).
Due candidati al vaccino hanno terminato gli studi di fase I: un vaccino vivo ricombinante a base di virus del morbillo chikungunya e il vaccino VRC-CHKVLP059-00-VP, VLP., Il vaccino chikungunya vivo ricombinante a base di virus del morbillo aveva una buona immunogenicità, anche in presenza di immunità al morbillo, era sicuro e aveva un profilo di tollerabilità generalmente accettabile.Il vaccino VLP, VRC-CHKVLP059-00-VP era anche immunogenico, sicuro e ben tollerato.84
Onere economico
In India, l’epidemia di chikungunya del 2006 ha imposto alla comunità un pesante onere epidemiologico e una perdita di produttività. L’onere nazionale di chikungunya è stato stimato in 25.588 DALYS persi durante l’epidemia del 2006., L’artralgia persistente è stata trovata per imporre l’onere pesante, rappresentando 69% dei DALYS totali. La perdita di produttività in termini di perdita di reddito è stata stimata in un minimo di 6 milioni di USD.Altri 85 studi effettuati in India hanno riferito che l’onere per l’Andhra Pradesh era di 6600 DALYS (costo: US US 12,400,000). Mentre l’onere era moderato, i costi erano elevati e per lo più di tasca.86
Uno studio condotto con poliziotti militari a La Réunion nel giugno 2006 ha riportato che la maggior parte dei pazienti sintomatici (93.,7%) lamentava uno stadio cronico della malattia, che è caratterizzato da dolori alle articolazioni o alle ossa, o entrambi, sebbene l’indagine sia stata fatta 6 mesi dopo il picco epidemico. La maggior parte degli adulti che lavorano sono disabili con perdita di mobilità, disabilità della mano e reazione depressiva, che può durare per settimane o mesi e ha conseguenze negative in salute, organizzazione sociale ed economia nelle aree epidemiche.87,88
Con questi antecedenti, se l’epidemia si diffonde in tutto il Messico, gli adulti che lavorano infetti saranno incapaci e aumenteranno l’onere economico.,
Conclusione
L’arrivo di CHIKV in America sarà una sfida per il sistema sanitario pubblico e un onere economico significativo. La probabilità di trasmissione autoctona nel resto del Messico e negli Stati Uniti è elevata a causa dell’ubiquità del vettore. Lo sviluppo economico non protegge i paesi dalle malattie trasmesse da vettori; gli stili di vita moderni possono amplificare un’epidemia attraverso i viaggi, l’invecchiamento della popolazione e la produzione di rifiuti solidi che possono ospitare le zanzare Aedes.
Finanziamento
Non è stato fornito alcun sostegno finanziario.
Conflitto di interessi
Gli autori non hanno conflitti di interesse da dichiarare.