niveluri ale structurii proteice
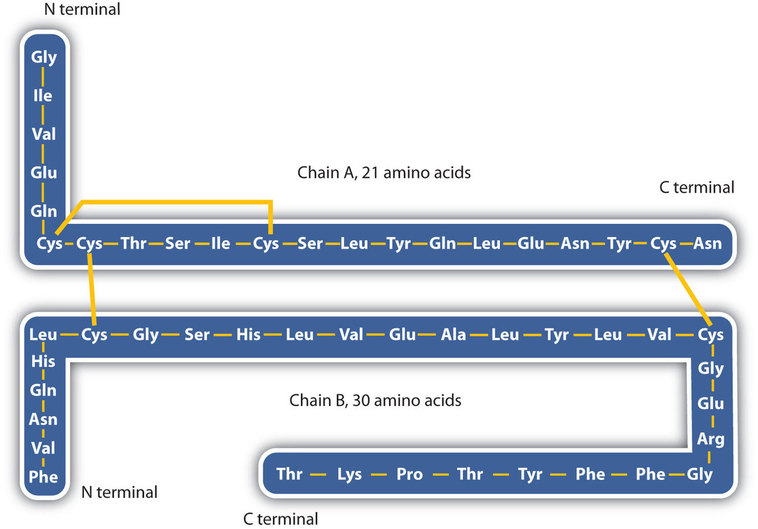
structura proteinelor este în general descrisă ca având patru niveluri organizaționale. Prima dintre acestea este structura primară, care este numărul și secvența aminoacizilor din lanțul sau lanțurile polipeptidice ale unei proteine, începând cu gruparea amino liberă și menținută de legăturile peptidice care leagă fiecare aminoacid de următorul. Structura primară a insulinei, compusă din 51 de aminoacizi, este prezentată în figura \(\PageIndex{1}\).,
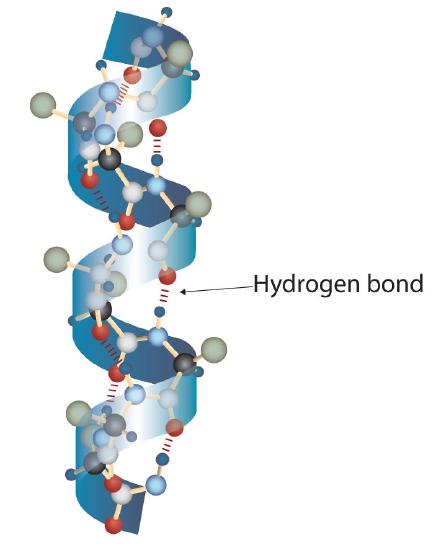
O moleculă de proteină nu este o întâmplare amestec de lanțuri polipeptidice. În schimb, lanțurile sunt aranjate în conformații unice, dar specifice. Termenul structură secundară se referă la aranjamentul fix al coloanei vertebrale polipeptidice., Pe baza studiilor cu raze X, Linus Pauling și Robert Corey au postulat că anumite proteine sau porțiuni de proteine se răsucesc într-o spirală sau o helix. Această helix este stabilizată prin legarea hidrogenului intrachain între atomul de oxigen carbonil al unui aminoacid și atomul de hidrogen amidă patru aminoacizi în lanț (situat pe următoarea rotire a helixului) și este cunoscut ca o α-helix dreaptă. X ray datele indică faptul că acest helix face un viraj pentru fiecare 3.6 aminoacizi, și lanțuri laterale de acești aminoacizi proiect de exterior din spiralat vertebrală (Figura \(\PageIndex{2}\))., Α-keratinele, găsite în păr și lână, sunt exclusiv α-elicoidale în conformație. Unele proteine, cum ar fi gama globulina, chimotripsina și citocromul c, au o structură elicoidală mică sau deloc. Altele, cum ar fi hemoglobina și mioglobina, sunt elicoidale în anumite regiuni, dar nu și în altele.
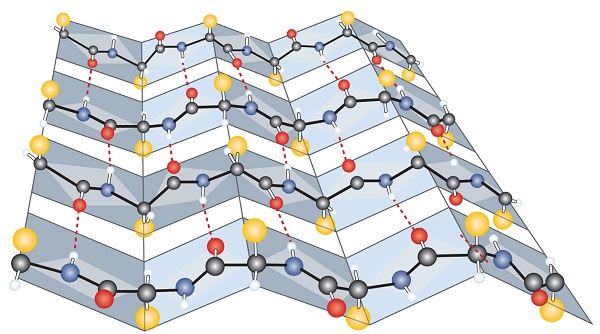
un Alt tip comun de structură secundară, numită β-plisat foaie de conformație, este un sheetlike aranjament în care două sau mai extinse lanțuri polipeptidice (sau regiuni separate pe același lanț) sunt aliniate una lângă alta. Aliniate segmente pot rula fie paralel sau antiparalel—asta este, N-terminale se pot confrunta în aceeași direcție adiacente lanțuri sau în direcții diferite și sunt conectate prin interchain legături de hidrogen (Figura \(\PageIndex{3}\))., Foaia plisată β este deosebit de importantă în proteinele structurale, cum ar fi fibroina de mătase. Se observă, de asemenea, în porțiuni ale multor enzime, cum ar fi carboxipeptidaza A și lizozima.
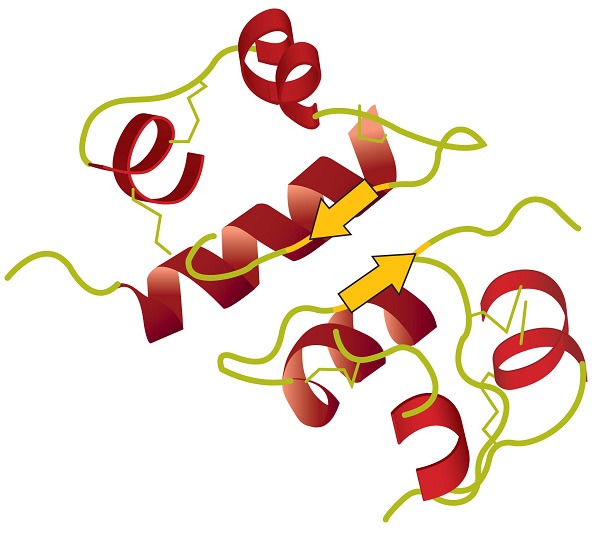
structura Terțiară se referă la unic tridimensional forma de proteine ca un întreg, ceea ce duce la plierea și îndoirea proteine vertebrală. Structura terțiară este strâns legată de funcționarea biochimică adecvată a proteinei. Figura \(\PageIndex{4}\) prezintă o reprezentare a structurii tridimensionale a insulinei.
Patru tipuri majore de atractiv interacțiuni determină forma și stabilitatea structura terțiară a proteinelor. Ai studiat mai multe dintre ele anterior.
- lipirea Ionică. Legăturile ionice rezultă din atracțiile electrostatice dintre lanțurile laterale încărcate pozitiv și negativ de aminoacizi., De exemplu, atracție reciprocă între un acid aspartic ion carboxilat și lizină amoniu ion ajută să mențină un anumit pliat zonă de proteine (o parte (a) din Figura \(\PageIndex{5}\)).
- lipirea hidrogenului. Legăturile de hidrogen se formează între un atom de oxigen foarte electronegativ sau un atom de azot și un atom de hidrogen atașat la un alt atom de oxigen sau un atom de azot, cum ar fi cele găsite în lanțurile laterale de aminoacizi polari., Legarea hidrogenului (precum și atracțiile ionice) este extrem de importantă atât în interacțiunile intra – cât și intermoleculare ale proteinelor (partea (b) din Figura \(\PageIndex{5}\)).
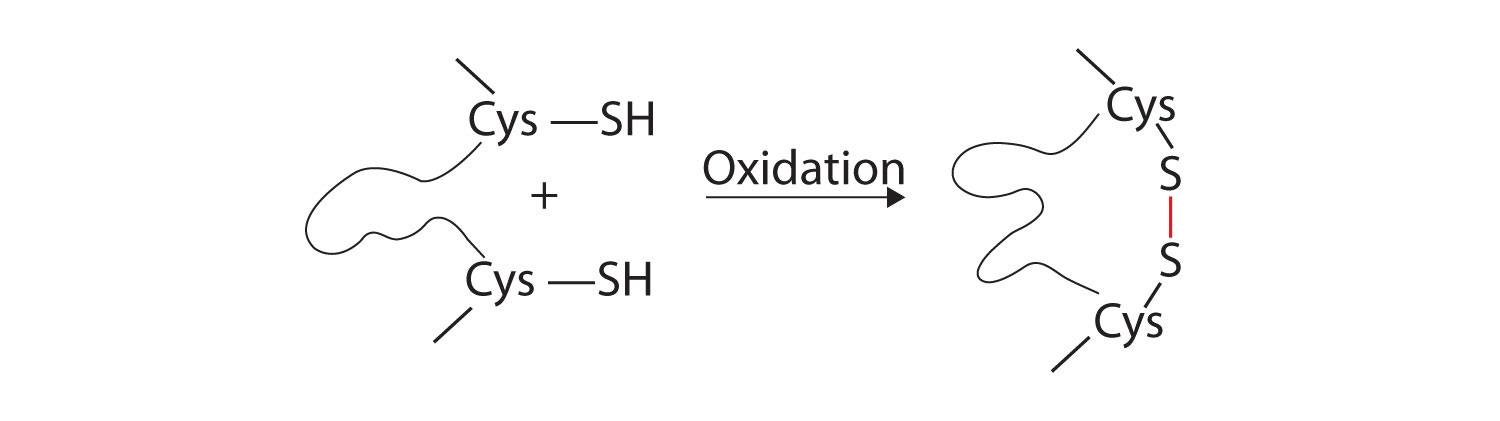
- legături disulfidice. Două unități de aminoacizi cisteină pot fi apropiate împreună pe măsură ce molecula de proteină se îndoaie. Oxidarea și legarea ulterioară a atomilor de sulf în grupările sulfhidril (SH) foarte reactive conduc la formarea cistinei (partea (c) din Figura \(\PageIndex{5}\))., Intrachain legăturilor disulfurice sunt găsite în multe proteine, inclusiv insulină (bare galbene în Figura \(\PageIndex{1}\)) și au un puternic efect stabilizator asupra structurii terțiare.
- forțele de dispersie. Forțele de dispersie apar atunci când un atom normal nepolar devine polar momentan datorită unei distribuții inegale a electronilor, ceea ce duce la un dipol instantaneu care induce o deplasare a electronilor într-un atom nepolar vecin., Forțele de dispersie sunt slabe, dar pot fi importante atunci când alte tipuri de interacțiuni lipsesc sau sunt minime (partea (d) din Figura \(\PageIndex{5}\)). Acesta este cazul fibroinei, proteina majoră din mătase, în care o proporție mare de aminoacizi din proteină au lanțuri laterale nepolare. Termenul de interacțiune hidrofobă este adesea folosit greșit ca sinonim pentru forțele de dispersie. Interacțiunile hidrofobe apar deoarece moleculele de apă se angajează în legarea hidrogenului cu alte molecule de apă (sau grupuri în proteine capabile să lege hidrogenul)., Deoarece grupurile nepolare nu se pot angaja în legarea hidrogenului, proteina se pliază astfel încât aceste grupuri să fie îngropate în partea interioară a structurii proteice, minimizând contactul lor cu apa.când o proteină conține mai mult de un lanț polipeptidic, fiecare lanț se numește subunitate. Aranjamentul mai multor subunități reprezintă un al patrulea nivel de structură, structura cuaternară a unei proteine. Hemoglobina, cu patru lanțuri sau subunități polipeptidice, este cel mai frecvent citat exemplu de proteină având structură cuaternară (figura \(\PageIndex{6}\))., Structura cuaternară a unei proteine este produsă și stabilizată prin aceleași tipuri de interacțiuni care produc și mențin structura terțiară. O reprezentare schematică a celor patru niveluri ale structurii proteinei este în figura \(\PageIndex{7}\).
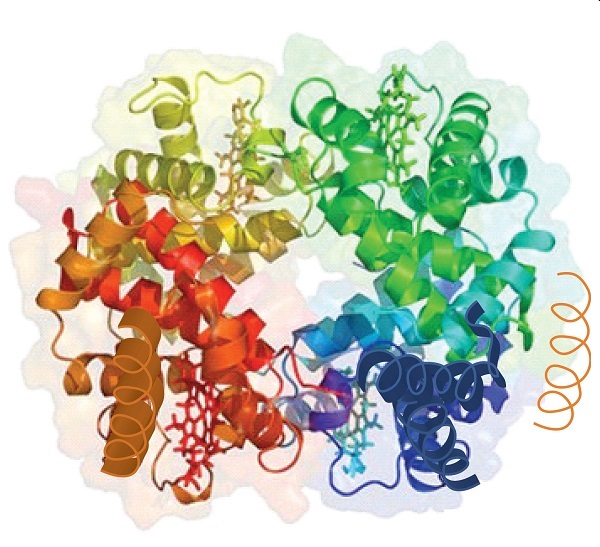
Figura \(\PageIndex{6}\) Structura Cuaternară a Hemoglobinei. Hemoglobina este o proteină care transportă oxigenul în organism., 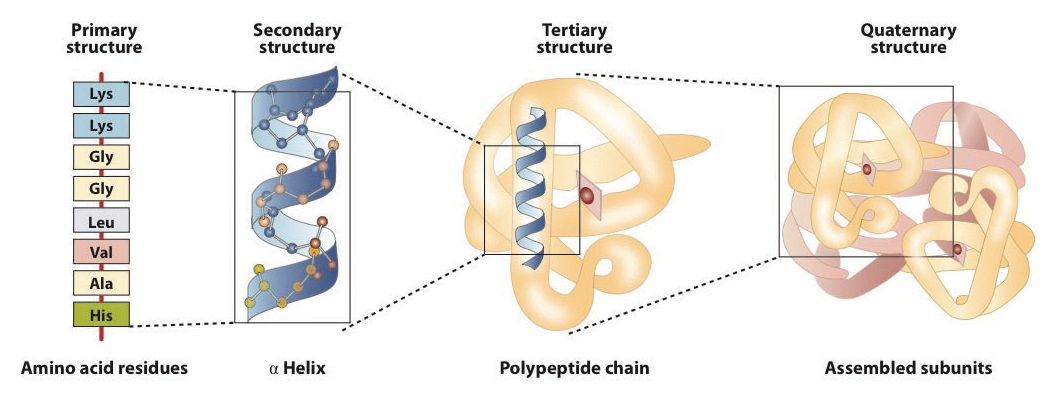
Figura \(\PageIndex{7}\): Niveluri de Structură în Proteine structura primară constă din anumite secvență de aminoacizi. Lanțul peptidic rezultat se poate răsuci într-o α-helix, care este un tip de structură secundară. Acest segment elicoidal este încorporat în structura terțiară a lanțului polipeptidic pliat., Lanțul polipeptidic unic este o subunitate care constituie structura cuaternară a unei proteine, cum ar fi hemoglobina care are patru lanțuri polipeptidice.