Obiectivele de Învățare
După finalizarea această secțiune, ar trebui să fie capabil să
-
- scrie o ecuație reprezintă formarea unui săpun.
- identificați structura grăsimii necesare pentru a produce un săpun dat.
- identificați structura unui săpun, având în vedere structura grăsimii din care este produsă.descrieți mecanismul prin care săpunurile își exercită acțiunea de curățare.,
- oferiți o explicație chimică a problemelor întâmpinate atunci când săpunurile carboxilate sunt utilizate în zonele cu apă dură și explicați cum pot fi depășite prin utilizarea detergenților sulfonați.
termeni cheie
asigurați-vă că puteți defini și utiliza în context termenii cheie de mai jos.,
- hidrofile
- lipofile (hidrofobe)
- amfifile
- micele
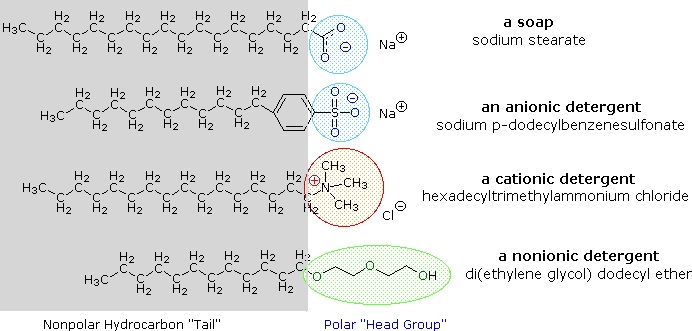
acizi Carboxilici și săruri cu lanțuri alchilice mai mult de opt atomi de carbon prezintă un comportament neobișnuit în apă datorită prezenței hidrofili (CO2) și hidrofobe (alchil), regiuni în aceeași moleculă. Astfel de molecule sunt denumite amfifile (Gk. amphi = ambele) sau amphipathic. Acizii grași alcătuiți din zece sau mai mulți atomi de carbon sunt aproape insolubili în apă și, datorită densității lor mai mici, plutesc la suprafață atunci când sunt amestecați cu apă., Spre deosebire de parafină sau alte alcani, care tind să baltă pe apele de suprafață, acești acizi grași se întinde uniform într-un domeniu extins de apă de suprafață, în cele din urmă formând o monomoleculare strat în care polare grupările carboxil sunt hidrogen legat la apa interfață, și lanțuri de hidrocarburi sunt aliniate împreună departe de apă. Acest comportament este ilustrat în diagrama din dreapta. Substanțele care se acumulează pe suprafețele apei și modifică proprietățile suprafeței se numesc surfactanți.,sărurile de metale alcaline ale acizilor grași sunt mai solubile în apă decât acizii înșiși, iar caracterul amfifilic al acestor substanțe le face, de asemenea, agenți tensioactivi puternici. Cele mai frecvente exemple de astfel de compuși sunt săpunurile și detergenții, dintre care patru sunt prezentate mai jos. Rețineți că fiecare dintre aceste molecule are un lanț nepolar de hidrocarburi,” coada „și un”grup de cap” polar (adesea ionic)., Utilizarea unor astfel de compuși ca agenți de curățare este facilitată de caracterul lor de surfactant, care scade tensiunea superficială a apei, permițându-i să pătrundă și să ude o varietate de materiale.
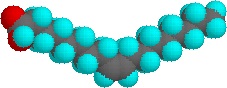
cantități foarte mici din acești surfactanți se dizolvă în apă pentru a da o dispersie aleatorie a moleculelor de solut. Cu toate acestea, atunci când concentrația este crescută, apare o schimbare interesantă. Moleculele surfactantului se asamblează reversibil în agregate polimoleculare numite Miceli., Prin colectarea lanțurilor hidrofobe împreună în centrul micelului, întreruperea structurii legate de hidrogen a apei lichide este minimizată, iar grupurile de cap polar se extind în apa din jur, unde participă la legarea hidrogenului. Aceste Miceli sunt adesea de formă sferică, dar pot presupune și forme cilindrice și ramificate, așa cum este ilustrat în dreapta. Aici grupul de cap polar este desemnat de un cerc albastru, iar coada nepolară este o linie neagră în zig-zag.
cel mai vechi agent de curățare amfifil cunoscut oamenilor este săpunul., Săpunul este fabricat prin hidroliza catalizată de bază (saponificare) a grăsimilor animale (vezi mai jos). Înainte ca hidroxidul de sodiu să fie disponibil în comerț, a fost utilizată o soluție fierbinte de carbonat de potasiu scurs din cenușă de lemn. Săpunurile moi de potasiu au fost apoi transformate în săpunurile de sodiu mai grele prin spălare cu soluție de sare. Importanța săpunului pentru civilizația umană este documentată de istorie, dar unele probleme asociate cu utilizarea sa au fost recunoscute. Una dintre acestea este cauzată de aciditatea slabă (PKA ca. 4.9) din acizii grași., Soluțiile de săpunuri de metale alcaline sunt ușor alcaline (pH 8 până la 9) datorită hidrolizei. Dacă pH-ul unei soluții de săpun este redus de contaminanți acide, acizii grași insolubili precipită și formează o spumă. O a doua problemă este cauzată de prezența sărurilor de calciu și magneziu în alimentarea cu apă (apă tare). Acești cationi bivalenți provoacă agregarea micelelor, care apoi se depun ca o spumă murdară.aceste probleme au fost atenuate de dezvoltarea amfifilelor sintetice numite detergenți (sau sindet)., Folosind un acid mult mai puternic pentru grupul capului polar, soluțiile de apă ale amfifilului sunt mai puțin sensibile la modificările pH-ului. De asemenea, funcțiile de sulfonat utilizate pentru aproape toate detergenții anionici conferă o solubilitate mai mare micelelor care încorporează cationii alcalino-pământoși găsiți în apa tare. Variațiile pe tema amfifilă au dus la dezvoltarea altor clase, cum ar fi detergenții cationici și neionici prezentați mai sus. Detergenții cationici prezintă adesea proprietăți germicide, iar capacitatea lor de a schimba pH-ul suprafeței le-a făcut utile ca îndulcitori de țesături și balsamuri de păr., Aceste versatil chimice „instrumente” au transformat dramatic de uz casnic și de îngrijire personală curățare piețele de produse în ultimii cincizeci de ani
Reacții Chimice de Grăsimi și Uleiuri
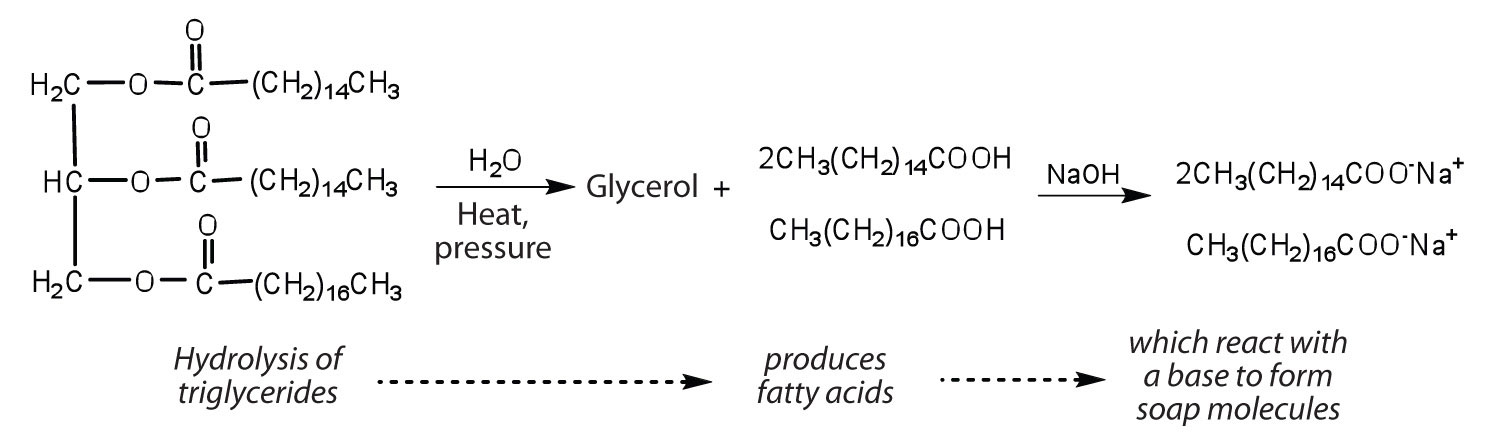
Grăsimi și uleiuri pot participa într-o varietate de reacții chimice—de exemplu, pentru că trigliceridele sunt esteri, ele pot fi hidrolizate în prezența unui acid, bază sau specifice de enzime numite lipaze. Hidroliza grăsimilor și uleiurilor în prezența unei baze este utilizată pentru a face săpun și se numește saponificare., Astăzi, majoritatea săpunurilor sunt preparate prin hidroliza trigliceridelor (adesea din seu, ulei de nucă de cocos sau ambele) folosind apă sub presiune și temperatură ridicată . Carbonat de sodiu sau hidroxid de sodiu este apoi folosit pentru a converti acizii grași să sărurile lor de sodiu (săpun molecule):
Contribuabili și Atribuții
-
Dr. Dietmar Kennepohl FCIC (Profesor de Chimie, Universitatea Athabasca)
-
Prof. dr. Steven Farmer (Sonoma state University)
-
William Reusch, Profesor Emerit (Michigan state U.,), Virtual manual of Organic Chemistry
- the Basics of general, Organic, and Biological Chemistry by David W. Ball, John W. Hill, and Rhonda J. Scott.