Normal aldosteron fiziologie
Aldosteron participă la homeostazia de volumul de sânge circulant și ser concentrația de potasiu; acestea, la rândul lor, feed-back pentru a regla secreția de aldosteron de către zona glomerulosa din cortexul suprarenal. Secreția de aldosteron este stimulată de o epuizare reală sau aparentă a volumului sanguin detectată de receptorii de întindere și de o creștere a concentrațiilor serice de ioni de potasiu; este suprimată de hipervolemie și hipopotasemie.,
mecanismele de reglare secreția de aldosteron sunt complexe, care implică zona glomerulosa a glandelor suprarenale, a aparatului juxtaglomerular din rinichi, sistemul cardiovascular, sistemul nervos autonom, plămâni și ficat (vezi imaginea de mai jos). Factorii majori care stimulează producerea și eliberarea aldosteronului de către zona glomerulosa sunt angiotensina II și concentrația plasmatică de potasiu. Aparatul juxtaglomerular este principalul situs de reglare a producției de angiotensină II.,
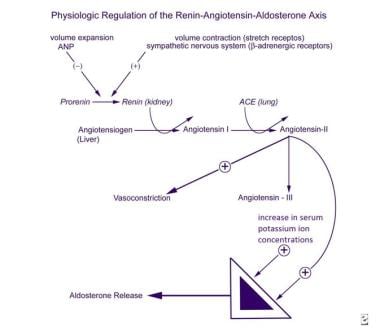 reglarea fiziologică a axei renină-angiotensină-aldosteron. ACTH stimulează secreția de aldosteron într-un mod acut și tranzitoriu, dar nu pare să joace un rol semnificativ în reglarea pe termen lung a secreției mineralocorticoide. Inhibitorii majori ai zonei glomerulosa includ peptida natriuretică atrială circulantă (ANP) și, local, dopamina., Deși nivelurile ANP sunt clar crescute în hiperaldosteronism, nici ANP, nici dopamina nu au fost implicate ca o cauză principală a secreției de aldosteron dezordonate clinic.s-a demonstrat că metoclopramida crește secreția de aldosteron, sugerând că dopamina poate inhiba tonic eliberarea de aldosteron. Rolurile fiziologice ale adrenomedullin și peptidei intestinale vasoactive (VIP) asupra secreției de aldosteron rămân de clarificat, deși ambele neuropeptide sunt produse în zona glomerulosa de șobolan.,sinteza proreninei, conversia sa în renină și secreția sa sistemică sunt stimulate de contracția volumului sanguin detectată de receptorii de întindere, stimularea beta-adrenergică a sistemului nervos simpatic și prostaglandinele I2 și E2. Aceste procese sunt inhibate de expansiunea volumului și ANP.
reglarea fiziologică a axei renină-angiotensină-aldosteron. ACTH stimulează secreția de aldosteron într-un mod acut și tranzitoriu, dar nu pare să joace un rol semnificativ în reglarea pe termen lung a secreției mineralocorticoide. Inhibitorii majori ai zonei glomerulosa includ peptida natriuretică atrială circulantă (ANP) și, local, dopamina., Deși nivelurile ANP sunt clar crescute în hiperaldosteronism, nici ANP, nici dopamina nu au fost implicate ca o cauză principală a secreției de aldosteron dezordonate clinic.s-a demonstrat că metoclopramida crește secreția de aldosteron, sugerând că dopamina poate inhiba tonic eliberarea de aldosteron. Rolurile fiziologice ale adrenomedullin și peptidei intestinale vasoactive (VIP) asupra secreției de aldosteron rămân de clarificat, deși ambele neuropeptide sunt produse în zona glomerulosa de șobolan.,sinteza proreninei, conversia sa în renină și secreția sa sistemică sunt stimulate de contracția volumului sanguin detectată de receptorii de întindere, stimularea beta-adrenergică a sistemului nervos simpatic și prostaglandinele I2 și E2. Aceste procese sunt inhibate de expansiunea volumului și ANP.
Renina transformă angiotensinogenului, un proenzyme sintetizată în ficat, în decapeptidă angiotensina I, care este apoi convertită în plămâni în octapeptide angiotensinei II prin enzimei de conversie a angiotensinei (ACE)., Angiotensina II este atât un stimulator al secreției de aldosteron, cât și un vasopresor puternic. Angiotensina II este metabolizată în angiotensina III, o heptapeptidă care este, de asemenea, un stimulator al secreției de aldosteron.sinteza și secreția prostaglandinelor I2 și E2 și funcția normală a receptorilor de întindere depind de concentrația intracelulară de calciu ionizat. Secreția renală de prostaglandină este stimulată de catecolamine și angiotensină II., Reglarea complexă a sintezei și secreției de aldosteron oferă mai multe puncte în care poate apărea perturbarea reglării secreției de aldosteron.aldosteronul este sintetizat din colesterol într-o serie de 6 etape biosintetice (vezi imaginea de mai jos). Doar ultimele 2 etape sunt specifice sintezei aldosteronului; primele 4 Se aplică și sintezei cortizolului de către zona fasciculata. În consecință, un defect al uneia dintre enzimele sintetice specifice de aldosteron nu duce la hipercortisolism și hiperplazie suprarenală secundară mediată de ACTH.,
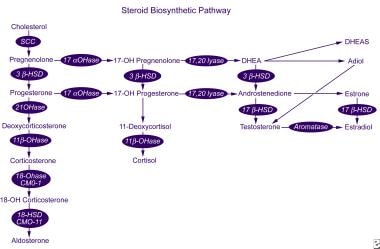 calea biosintetică a steroizilor.
calea biosintetică a steroizilor. enzimei de aldosteron-sintetazei este codificată de gena CYP11B2 și a 11β-hidroxilaza, 18-hidroxilazei, și 18-hydroxydehydrogenase activitate. Această genă este localizată pe cromozom uman brațul 8q24.3-tel, aproape de gene CYP11B1, care codifică 11β-hidroxilaza, enzima care catalizează etapa finală a sintezei de cortizol. Mutațiile acestor gene pot duce la o serie de tulburări ale sintezei aldosteronului (vezi diferențialele)., acțiunea aldosteronului asupra țesuturilor țintă (de exemplu, tubul renal distal, glandele sudoripare, glandele salivare și epiteliul intestinului gros) este mediată printr-un receptor mineralocorticoid specific. Receptorii mineralocorticoizi prezintă afinitate egală pentru mineralocorticoizi și cortizol, totuși receptorii aldosteronului din tubul distal și din altă parte sunt protejați de activarea mediată de cortizol de 11β-hidroxisteroid dehidrogenază tip 2, care transformă local cortizolul în cortizon inactiv.,termenul hiperaldosteronism primar (sau aldosteronism primar) se referă la o creștere independentă de renină a secreției de aldosteron. Această afecțiune este în principal o boală a vârstei adulte, cu incidența maximă în deceniile a patra până la a șasea de viață.mai mult de 90% din cazurile de PA se datorează fie unui adenom producător de aldosteron (APA), care reprezintă aproximativ 35% din cazuri (30-40%), fie hiperaldosteronismului idiopatic (IHA), care reprezintă aproximativ 60% din cazuri (aproape toate sunt bilaterale)., Hiperplazia suprarenală unilaterală (UAH) este o cauză rară de PA, reprezentând 1-2% din cazuri. Aproximativ 1% dintre pacienți prezintă carcinoame adrenocorticale care sunt pur secretoare de aldosteron și sunt de obicei mari la momentul diagnosticului; 1% prezent cu hiperaldosteronism familial și 1% prezent cu un adenom sau carcinom ectopic producătoare de aldosteron. hiperplazia suprarenală unilaterală reprezintă 14-17% din toate cazurile de PA unilaterală. Prevalența adenomului cortical în hiperplazia corticală este estimată la 6-24%., Prezentarea clinică și rezultatul pacienților cu hiperaldosteronism primar unilateral sunt similare indiferent de diagnosticul histopatologic. Hiperplazia adrenocorticală unilaterală este rară. APAs (uneori denumite aldosteronomas) sunt de obicei adenoame încapsulate benigne care au un diametru mai mic de 2 cm. Majoritatea cazurilor sunt solitare, deși în cel mult o treime din cazuri există dovezi de nodularitate în aceeași glandă suprarenală, sugerând că afecțiunea a apărut într-o glandă hiperplastică anterior.,pacienții cu IHA au îngroșare bilaterală și nodularitate variabilă a cortexului suprarenale. Există un spectru larg de severitate pentru această tulburare, care poate fi nedetectată pentru perioade lungi de timp, fără hipokaliemie și doar hipertensiune arterială ușoară. Sa sugerat că IHA apare ca urmare a unui factor de stimulare a cortexului suprarenale nedetectat. Alternativ, tulburarea poate apărea ca urmare a unei mutații activatoare într–o genă specifică cortexului suprarenale. Nici o ipoteză nu a fost dovedită.,formele moștenite de hiperaldosteronism primar reprezintă doar 1% din cazuri, dar sunt mai susceptibile să apară în anii copilăriei. Aceste forme includ familial hiperaldosteronism (FH), tipurile I, II, și III.
Familiale hiperaldosteronism de tip I,
FH tip I (FH-am), de asemenea, menționată ca glucocorticoizi-remediabile hiperaldosteronism (GRA), pot fi detectate la persoanele asimptomatice în timpul screening-ul de la descendenții persoanelor afectate, sau pacienți pot prezenta in copilarie cu hipertensiune arterială, slăbiciune, și eșecul de a prospera din cauza hipopotasemie., FH-I este moștenit într-o manieră autosomală dominantă și are o frecvență scăzută de mutații noi.prima descriere clinică a GRA a apărut în 1966, iar mecanismul genetic a fost descoperit în 1992. FH-mi apare ca un rezultat de trecere peste inegale extrem de legate CYP11B1 (de 11β-hidroxilaza gene) și CYP11B2 (de aldosteron-sintetazei gene) în timpul meiozei, producând un anti-Lepore-tip fusion produs., Acest genetice rearanjare cauze expresia CYP11B2 să fie plasate sub controlul CYP11B1 promotor și sinteza de aldosteron să fie anormal reglementate de ACTH, mai degrabă decât de sistemul renină-angiotensină.
rezultatul este ACTH-dependente de aldosteron de producție și producția de 17-hidroxilați analogi de 18-hydroxycortisol sub ACTH regulamentul de ectopică enzimei de exprimare în zona fasciculata. Hiperplazia bilaterală a zonei fasciculata apare și în urină apar niveluri ridicate de 18-hidroxisteroizi noi., Formarea adenomului este rară, dar pacienții au o creștere semnificativă a incidenței anevrismelor cerebrovasculare, pentru care necesită screening.
Familiale hiperaldosteronism de tip II
FH tip II (AG-II) este o organizație non–glucocorticoizi-suppressible moștenit formă de hiperaldosteronism, care a fost recunoscut ca o entitate distinctă de Gordon et al, deși cazuri au fost anterior descrise în 1980. Ca FH-am, este moștenit într-un autosomal dominantă mod. Spre deosebire de FH-i, unele tipuri de FH-II prezintă o rată ridicată de formare a adenomului.,mecanismul și locusul genetic nu au fost încă identificate, deși genele CYP11B și ale receptorilor pentru renină și angiotensină II au fost excluse. Cu toate acestea, legătura a fost stabilită pentru un număr de familii la banda 7p22. De asemenea, sa speculat că FH-II nu este o singură tulburare.
Familiale hiperaldosteronism tip III,
FH-III este de o rară autozomal dominantă formă de PA caracterizează prin debut precoce hipertensiune arterială, nonglucocorticoid-remediabile hiperaldosteronism, și hipokaliemie., Germline heterozigot mutații missense de KCNJ5 gene, codare Kir3.4, un membru din interior de rectificare K+ canal familie, au fost identificate ca fiind cauza FH-III. Până în prezent, 4 mutații (G151R, G151E, T158A, și I157S) au fost raportate în 6 familii. fenotipul clinic al pacienților care prezintă mutațiile de mai sus variază de la PA severă și hipertensiune arterială refractară la tratamentul medical care necesită adrenalectomie bilaterală, până la hipertensiunea arterială ușoară sau moderată care răspunde la terapia medicală. La unii pacienți, a fost descrisă hiperplazia suprarenală.,diferite studii din diferite centre raportează o prevalență a mutațiilor somatice kcnj5 în ap sporadice, variind între 30-65%. Există 2 mutații recurente, G151R și L168R, raportate de către toate studiile, întrucât nu există un raport de 3 nucleotide stergere, delI157. reziduurile afectate atât ale liniei germinale, cât și ale mutațiilor somatice sunt în sau în apropierea filtrului de selectivitate al canalului de potasiu Kir3.4 și sunt foarte conservate între diferite specii., Studiile electrofiziologice demonstrează că aceste mutații duc la pierderea selectivității canalului, cu o conductanță crescută de Na+ care duce la depolarizarea membranei. În celulele glomerulosa zona, depolarizarea membranei conduce la deschiderea canalelor Ca2 + activate de tensiune, cu activarea căii de semnalizare a calciului, mediatorul major al producției de aldosteron.APAs cu mutații KCNJ5 sunt mai răspândite la femei decât la bărbați și la pacienții mai tineri. Acestea sunt, de asemenea, asociate cu niveluri mai mari de aldosteron preoperator., Acestea nu sunt legate de dimensiunea tumorii, dar sunt legate de niveluri mai mari de aldosteron și concentrații mai mici de K+.
Transcriptomului și în timp real a reacției în lanț a polimerazei (PCR) analizele demonstrează că Apa cu KCNJ5 mutații prezintă crescut expresie de gena CYP11B2 și transcripțional reglementare NR4A2, crescând astfel producția de aldosteron. De asemenea, sa constatat că apa cu și fără mutații KCNJ5 prezintă modele de expresie genetică ușor diferite., Un alt studiu raportează niveluri de ARNm KCNJ5 mai mari în apa cu mutații KCNJ5 și semnificativ mai mari în APA decât adenoamele producătoare de cortizol și feocromocitoamele.
mutații Somatice în ATP1A1 (gena care codifică alfa-1 subunitate de Na+/K+ Atpazei, un membru de tip P Atpazei de familie), ATP2B3 (gena care codifică membrana plasmatică de calciu transportul Atpazei 3 , un alt membru al P-tip Atpazei de familie), sau CACNA1D (gena care codifică Cav1.,3, subunitatea alfa a unui canal de calciu cu tensiune de tip L) sunt prezente în aproximativ 6%, 1% și 8% din toate cazurile de adenom producătoare de aldosteron, respectiv. Mai recent, au fost raportate mutații ale liniei germinale de novo în CACNA1D la 2 copii cu un sindrom anterior nedescris care a prezentat PA și anomalii neuromusculare., hiperaldosteronismul secundar este un termen colectiv pentru un grup divers de tulburări caracterizate prin activarea fiziologică a axei renină-angiotensină-aldosteron (R-A-A) ca mecanism homeostatic conceput pentru a menține concentrațiile serice de electroliți sau volumul de lichid. În prezența funcției renale normale, poate duce la hipokaliemie.hiperaldosteronismul secundar poate fi împărțit în 2 categorii, 1 cu hipertensiune asociată și 1 fără., Prima categorie include hipertensiunea renovasculară, care rezultă din ischemia renală și hipoperfuzia care conduc la activarea axei R-A-A. Cele mai frecvente cauze ale stenozei arterei renale la copii sunt hiperplazia fibromusculară și neurofibromatoza. Hipokaliemia poate apărea la până la 20% dintre pacienți.nivelurile activității reninei plasmatice (PRA) sunt adesea în intervalul de referință, dar nivelurile crescute de PRA pot fi detectate după provocare cu o singură doză de captopril 1 mg/kg., De asemenea, se consideră că ischemia renală stă la baza hiperaldosteronismului secundar observat în hipertensiunea malignă.Hiperreninemia și aldosteronismul secundar au fost, de asemenea, raportate la pacienții cu feocromocitom, aparent ca urmare a stenozei funcționale a arterei renale. Tumorile producătoare de renină sunt foarte rare și se observă niveluri foarte ridicate de PRA (până la 50 ng/mL/h), frecvent cu un raport crescut prorenin-renină. Tumorile sunt, în general, de origine renală și includ tumori Wilms și carcinoame cu celule renale.,hiperkaliemia datorată insuficienței renale cronice provoacă, de asemenea, hiperaldosteronism secundar. Raportul scăzut de sodiu-potasiu poate fi măsurat în salivă și scaun. Hipertensiunea indusă de ciclosporină la pacienții cu transplant de organe solide poate implica, de asemenea, o componentă a hiperaldosteronismului.hiperaldosteronismul secundar în absența hipertensiunii arteriale apare ca urmare a încercărilor homeostatice de a menține concentrația de sodiu sau volumul circulator sau de a reduce concentrația de potasiu., Condițiile clinice în care poate apărea includ diaree, transpirație excesivă, stări de ieșire cardiacă scăzută și hipoalbuminemie datorată bolii hepatice sau renale sau sindromului nefrotic. Hiperaldosteronismul secundar poate apărea, de asemenea, în dezvoltare la nou-născuți (vezi mai jos).dependența crescută de mineralocorticoizi la tineri
dependența de mineralocorticoizi a reabsorbției de sodiu este crescută în copilărie și copilărie, atingând un maxim în perioada neonatală înainte de a scădea progresiv odată cu înaintarea în vârstă., Această creștere apare deoarece reabsorbția sodiului și a apei de către tubul proximal este cel mai puțin eficientă în viața timpurie, ducând la o încărcare crescută a sodiului și a apei la nivelul tubului renal distal.deoarece resorbția sodiului și a apei din tubul distal este mediată de axa R-A-A, PRA este de aproximativ 10 ori până la 20 de ori mai mare la un nou-născut decât la un adult., În consecință, nou-născuții show relativă crește într-aldosteron ratele de producție (>300 µg/m2/zi, față de 50 µg/m2/zi la adult) și concentrațiile plasmatice de aldosteron (80 pg/dL vs 16 pg/dL). Aceste creșteri în viața timpurie explică de ce sugarii mici prezintă simptome clinice profunde ale hiperaldosteronismului care se îmbunătățesc treptat odată cu înaintarea vârstei.