starea de oxidare a unui atom este sarcina acestui atom după aproximarea ionică a legăturilor sale heteronucleare. Numărul de oxidare este sinonim cu starea de oxidare. Determinarea numerelor de oxidare din structura Lewis (figura 1a) este chiar mai ușoară decât deducerea acesteia din formula moleculară (figura 1b). Numărul de oxidare al fiecărui atom poate fi calculat scăzând suma perechilor singulare și a electronilor pe care îi câștigă din legături din numărul de electroni de valență., Legăturile dintre atomii aceluiași element (legături homonucleare) sunt întotdeauna împărțite în mod egal.
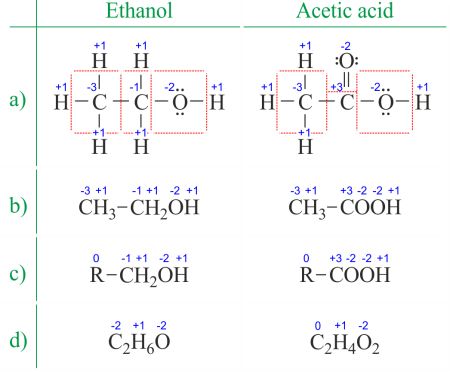
când aveți de-a face cu compuși organici și formule cu mai mulți atomi ai aceluiași element, este mai ușor să lucrați cu formule moleculare și numere medii de oxidare (figura 1D). Compușii organici pot fi scrise în așa fel încât orice lucru care nu se schimbă înainte de prima legătură C-C este înlocuit cu abrevierea R (figura 1C). Spre deosebire de radicalii din moleculele organice, R nu poate fi hidrogen. Deoarece electronii dintre doi atomi de carbon sunt distribuiți uniform, grupul R nu modifică Numărul de oxidare al atomului de carbon la care este atașat., Puteți găsi exemple de utilizare pe pagina împărțiți reacția redox în două jumătăți de reacții.
reguli pentru atribuirea numerelor de oxidare
- numărul de oxidare al unui element liber este întotdeauna 0.
- numărul de oxidare al unui ion monatomic este egal cu sarcina ionului.
- fluorul în compuși este întotdeauna atribuit unui număr de oxidare de -1.
- metalele alcaline (Grupa I) au întotdeauna un număr de oxidare de +1.
- metalelor alcalino-pământoase (grupa II) li se atribuie întotdeauna un număr de oxidare de +2.,
- oxigenul are aproape întotdeauna un număr de oxidare de -2, cu excepția peroxizilor (H2O2) unde este -1 și a compușilor cu fluor (OF2) unde este +2.
- hidrogenul are un număr de oxidare de +1 atunci când este combinat cu nemetale, dar are un număr de oxidare de -1 atunci când este combinat cu metale.
- suma algebrică a numerelor de oxidare ale elementelor dintr-un compus este zero.
- suma algebrică a stărilor de oxidare într-un ion este egală cu sarcina pe ion.