tendințe periodice
introducere
electronii sunt ținuți într-un atom sau ion de atracția electrostatică dintre nucleul încărcat pozitiv și electronii încărcați negativ. La speciile multi-electroni, electronii nu experimentează sarcina pozitivă completă a nucleului datorită ecranării de electroni care se află între electronul de interes și nucleu. Cantitatea de sarcină pozitivă care acționează efectiv asupra unui electron se numește sarcina nucleară efectivă., conceptul de sarcină nucleară efectivă (Z*) este important pentru înțelegerea proprietăților periodice. Sarcina nucleară efectivă este acea parte din sarcina nucleară totală pe care o experimentează un electron dat într-un atom. Aceasta este egală cu numărul atomic (Z) minus cantitatea (σ) pe care alți electroni din atom îl protejează pe atomul dat de nucleu.
Z * = Z-σ
exemplu: litiul are trei protoni și o configurație de electroni de 1s22s1., Electronul din orbitalul 2S este protejat de atracția completă a protonilor de către electronii orbitalului 1s (Figura 1). Astfel, Z * simțit de electronul 2S ar trebui să fie unul și nu trei. Cu toate acestea, electronul 2S al litiului nu se comportă ca și cum ar experimenta exact o încărcare +1 (Z* este de fapt aproximativ 1, 3 unități de încărcare). Acest lucru poate fi explicat prin faptul că orbitalul 2s are două maxime în funcția sa de probabilitate radială (Figura 1), iar maximele mai mici penetrează în maximul electronului 1s interior., Deși litiu electron 2s își petrece majoritatea timpului său în exterior lobul că orbital simți o încărcătură nucleară de +1, o parte din timp este în orbital 1s confruntă cu întreaga încărcătură nucleară de +3. Astfel, Z * este ceva mai mare decât +1.
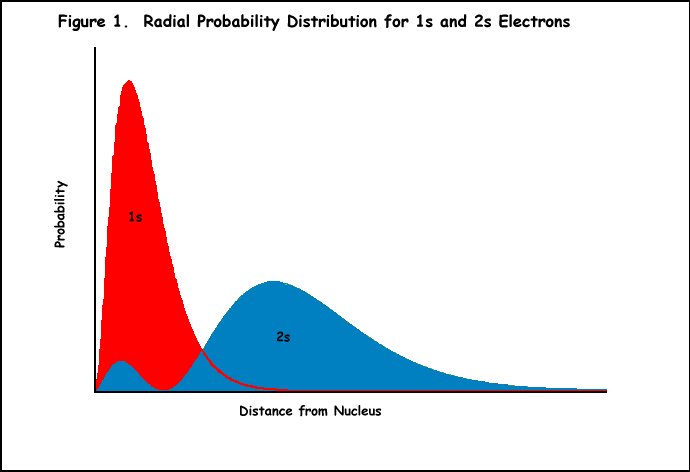
Slater Reguli pentru Determinarea σ
În 1930, J. S. Slater a formulat următorul set de norme empirice pentru determinarea valorilor de protectie constantă σ.,
-
Scrie configurația electronică a elementului și de grup în orbitali în ordinea următoare:
(1)(2s, 2p)(3s, 3p)(3d)(4s, 4p)(4d)(4f)(5s, 5p)…….. - pentru a stabili constanta de screening pentru orice electron, rezumați următoarele contribuții:
- electronii din grupuri din afara (la dreapta) Celui considerat nu contribuie la ecranare.
- electronii din același grup contribuie cu 0,35 la ecranare (cu excepția grupului 1s, unde o contribuție de 0.,30 este utilizat
- pentru electronii s sau p observați, fiecare electron din carcasa (n-1) contribuie cu 0,85 la ecranare și fiecare electron din (n-2), (n-3), … shell-urile contribuie cu 1.00 la ecranare
- pentru electronii d sau f observați, fiecare electron dintr-un grup subiacent contribuie cu 1.00 la ecranare.,
Exemplu: Calculați Z* pentru un 4s și 3d de electroni de la Zn
Determina configurația electronică pentru Zn
(1s)2(2s, 2p)8(3s, 3p)8(3d)10(4s)2
Pentru un 4s de electroni:
Stabilirea de screening constantă pentru 4s electron
σ = (1 x 0,35) + (18 x 0,85) + (10×1.00) = 25.65
Calcula eficient încărcătură nucleară
Z*= Z-σ = 30-25.65 = 4.,35
Pentru un 3d de electroni:
Stabilirea de screening constantă pentru 3d electron ![]()
Calcula eficient încărcătură nucleară ![]()
De la acest exemplu, puteți vedea că electronii 3d experiență mult mai mare sarcină pozitivă decât 4s electron și-ar fi ținut mai strâns. Astfel, electronii 4s vor fi primii eliminați atunci când Zn este ionizat.,
- cu Ajutorul lui Slater reguli, se calculează o valoare efectivă încărcătură nucleară simțit de (a) un electron se adaugă la 3s orbital de un atom de neon și (b) un electron fiind ionizat de la 2p orbital de neon atom.
 comentați rezultatele dvs. în raport cu stabilitatea configurației electronice a atomului neon.,
comentați rezultatele dvs. în raport cu stabilitatea configurației electronice a atomului neon.,
- calculați Z * pentru electronii de valență din atomii de la Li La Ne folosind (a) presupunerea că σ este egal cu numărul de electroni de coajă interioară și (b) regulile lui Slater. Trasați ambele seturi de rezultate pe același grafic și discutați.amintiți-vă de ce energia unui orbital NS este mai mică decât cea a unui orbital np. Utilizați aceste informații pentru a discuta presupunerea că aceste orbitale sunt întotdeauna considerate ca un grup (ns, np) în regulile lui Slater.
- graficul probabilității de a găsi electroni 3S, 3p, 3D și 4s în funcție de distanța radială față de nucleu poate fi vizualizat aici., Discutați aceste probabilități în raport cu regulile 2c și 2D din regulile lui Slater.
puteți accesa o foaie de calcul pentru calcularea taxelor nucleare eficiente aici. Dacă aveți nevoie de asistență în utilizarea Excel pentru plotarea datelor, încercați acest tutorial.
tabelul Periodic
ați utilizat tabelul periodic pe parcursul studiului dvs. de chimie. Citiți mai multe despre tabelul periodic aici. Mendeleev a fost unul dintre chimiștii timpurii care a recunoscut că proprietățile elementelor erau de natură periodică. Citiți din publicația originală a lui Mendeleev.,
tendințe periodice
în restul acestui modul, veți analiza tendințele periodice care există printre elemente. Începeți investigația vizionând acest film pe tendințele periodice.,
Raza Atomică
Există mai multe moduri de a defini raza atomic al unui atom:
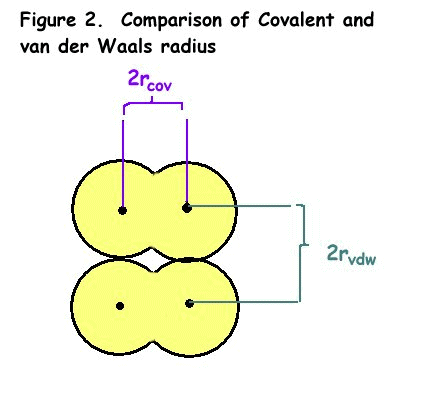
- raza covalenta (rcov), la jumătatea distanței dintre nucleele a doi atomi s-au alăturat într-o legătură covalentă
- van der Waals raza (rvdw), la jumătatea distanței dintre nucleele a doi atomi de moleculele vecine
- metalic de rază (rmet), pentru elemente metalice, la jumătatea distanței dintre nucleele a două vecine atomii din solid de metal
diferența dintre raza covalenta și van der Waals raza este prezentată în Figura 2.,
- Complot valorile de raze vs. numărul atomic pentru Grupa 1A elemente și Perioada 2 elemente. veți găsi
 datele de care aveți nevoie în această foaie de calcul Excel a datelor de proprietate fizică pentru elemente (făcând clic dreapta pe link vă va permite să salvați fișierul).
datele de care aveți nevoie în această foaie de calcul Excel a datelor de proprietate fizică pentru elemente (făcând clic dreapta pe link vă va permite să salvați fișierul).
- utilizați conceptul de încărcare nucleară eficientă pentru a raționaliza tendința valorilor razelor pentru elementele grupului 1a.,
- utilizați conceptul de încărcare nucleară eficientă pentru a raționaliza tendința valorilor razelor pentru perioada 2 elemente.
puteți vedea un scurt film care prezintă ceea ce ar fi trebuit să încheiați aici. amintiți-vă că energia de ionizare (de fapt prima energie de ionizare) este energia necesară pentru a îndepărta un electron din orbitalul extrem de ocupat al unui atom gazos.
- Complot energiile de ionizare pentru prima 86 elemente din tabelul periodic față de numărul atomic.,
 Afișați graficul atât ca grafic normal, cât și ca grafic cu bare. Explicați tendințele generale care apar într-o perioadă și în jos o familie folosind conceptul de încărcare nucleară eficientă. În fiecare perioadă apare o anomalie a tendinței generale cu elementul grup 3A și elementul grup 6a. Explicați acest comportament anormal.
Afișați graficul atât ca grafic normal, cât și ca grafic cu bare. Explicați tendințele generale care apar într-o perioadă și în jos o familie folosind conceptul de încărcare nucleară eficientă. În fiecare perioadă apare o anomalie a tendinței generale cu elementul grup 3A și elementul grup 6a. Explicați acest comportament anormal. - folosind regulile lui Slater, calculați Z * pentru Al, Al+, Al2+ și Al3+. Discutați rezultatele în raport cu energiile de ionizare așteptate pentru aceste specii.,
- calculați Z* pentru electronul de valență ns al litiului, sodiului și potasiului folosind presupunerea că σ este egal cu numărul de electroni cu coajă interioară. Rezultatele dvs. sunt în concordanță cu tendințele energiei de ionizare pentru aceste elemente? Discutați de ce sau de ce nu. afinitatea electronilor este schimbarea energiei care apare atunci când un electron este adăugat la un atom neutru, gazos.
PROBLEME Complot de electroni afinitatea pentru Principalele elemente de Grup ( Grup 1A-8A) în funcție de numărul atomic.,
 Afișați complotul atât ca grafic normal, cât și ca grafic cu bare. Explicați tendințele generale care apar într-o perioadă și în jos o familie folosind conceptul de încărcare nucleară eficientă. O anomalie a tendinței generale apare într-o perioadă în trecerea de la elementul grupului 1A la elementul grupului 2a și în trecerea de la grupul 4a la grupul 5a. o anomalie poate fi găsită și între rândurile 2 și 3 în coborârea unei perioade. Dați o explicație pentru fiecare dintre aceste anomalii., electronegativitatea este capacitatea unui atom dintr-o moleculă de a atrage electroni la sine.
Afișați complotul atât ca grafic normal, cât și ca grafic cu bare. Explicați tendințele generale care apar într-o perioadă și în jos o familie folosind conceptul de încărcare nucleară eficientă. O anomalie a tendinței generale apare într-o perioadă în trecerea de la elementul grupului 1A la elementul grupului 2a și în trecerea de la grupul 4a la grupul 5a. o anomalie poate fi găsită și între rândurile 2 și 3 în coborârea unei perioade. Dați o explicație pentru fiecare dintre aceste anomalii., electronegativitatea este capacitatea unui atom dintr-o moleculă de a atrage electroni la sine.PROBLEME  Schița un tabel periodic, indicând tendința de electronegativities la cel mai mic la cel mai mare. Corelați aceste tendințe cu sarcina nucleară eficientă și dimensiunea atomică.există multe proprietăți pentru care puteți investiga tendințele periodice. Există o foaie de calcul Excel frumos, care vă permite să se uite la tendințele pentru diverse proprietăți în 3-D., Descărcați foaia de calcul. Această foaie de calcul utilizează macro-uri pentru accesarea parcelelor. Dacă primiți un mesaj că macrocomenzile nu s-au descărcat din cauza setării de securitate, resetați setarea de securitate pentru Excel folosind meniul Instrumente. Va trebui să Activați editarea și, dacă vi se solicită, să-l faceți un document de încredere.
Schița un tabel periodic, indicând tendința de electronegativities la cel mai mic la cel mai mare. Corelați aceste tendințe cu sarcina nucleară eficientă și dimensiunea atomică.există multe proprietăți pentru care puteți investiga tendințele periodice. Există o foaie de calcul Excel frumos, care vă permite să se uite la tendințele pentru diverse proprietăți în 3-D., Descărcați foaia de calcul. Această foaie de calcul utilizează macro-uri pentru accesarea parcelelor. Dacă primiți un mesaj că macrocomenzile nu s-au descărcat din cauza setării de securitate, resetați setarea de securitate pentru Excel folosind meniul Instrumente. Va trebui să Activați editarea și, dacă vi se solicită, să-l faceți un document de încredere. 