masse atomique
Les Masses des atomes individuels sont très, très petites. En utilisant un appareil moderne appelé spectromètre de masse, il est possible de mesurer de telles masses minuscules. Un atome d’oxygène-16, par exemple, a une masse de \(2,66 \fois 10^{-23} \: \text{g}\). Bien que les comparaisons de masses mesurées en grammes auraient une certaine utilité, il est beaucoup plus pratique d’avoir un système qui nous permettra de comparer plus facilement les masses atomiques relatives., Les scientifiques ont décidé d’utiliser le nucléide de carbone 12 comme étalon de référence par lequel toutes les autres masses seraient comparées. Par définition, un atome de carbone 12 est affecté d’une masse de 12 unités de masse atomique \(\left( \text{amu} \right)\). Une unité de masse atomique est définie comme une masse égale à un douzième de la masse d’un atome de carbone 12. La masse de tout isotope de tout élément est exprimée par rapport à la norme carbone-12. Par exemple, un atome d’hélium-4, a une masse de \(4.0026 \: \text{amu}\). Un atome de soufre-32 a une masse de \(31.972 \: \text{amu}\).,
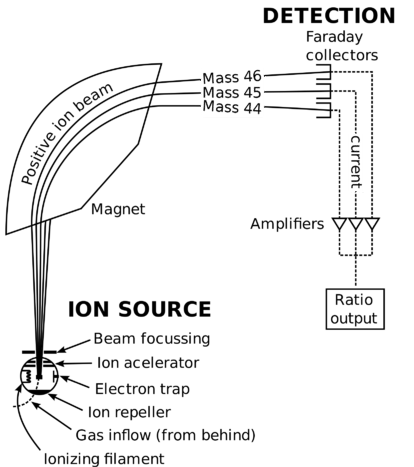
spectromètre de Masse schématique.
l’atome de carbone 12 a six protons et six neutrons dans son noyau pour un nombre de masse de 12. Étant donné que le noyau représente presque toute la masse de l’atome, un seul proton ou un seul neutron a une masse d’environ \(1 \: \text{amu}\). Cependant, comme le montrent les exemples d’hélium et de soufre, les masses d’atomes individuels ne sont pas des nombres entiers., En effet, la masse d’un atome est très légèrement affectée par les interactions des différentes particules dans le noyau, et la petite masse de l’électron est prise en compte.