Levels of Protein Structure
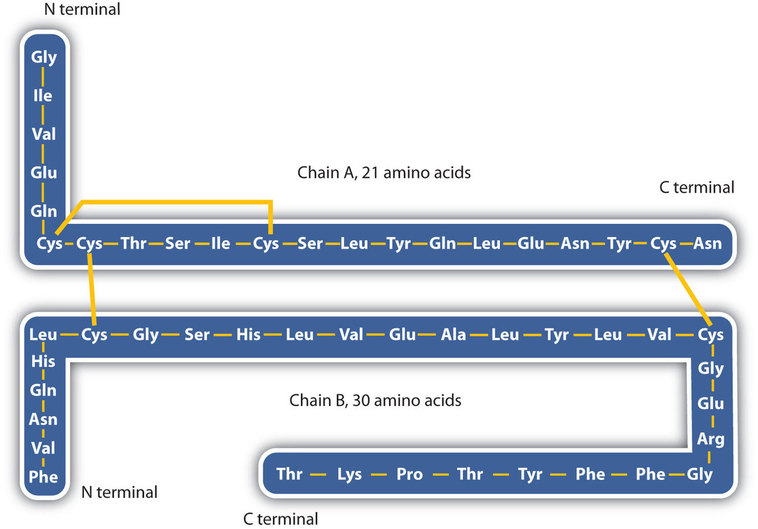
la estructura de las proteínas se describe generalmente como teniendo cuatro niveles organizativos. El primero de ellos es la estructura primaria, que es el número y la secuencia de aminoácidos en la cadena o cadenas polipeptídicas de una proteína, comenzando con el grupo amino libre y mantenido por los enlaces peptídicos que conectan cada aminoácido al siguiente. La estructura primaria de la insulina, compuesta de 51 aminoácidos, se muestra en la figura \(\PageIndex{1}\).,
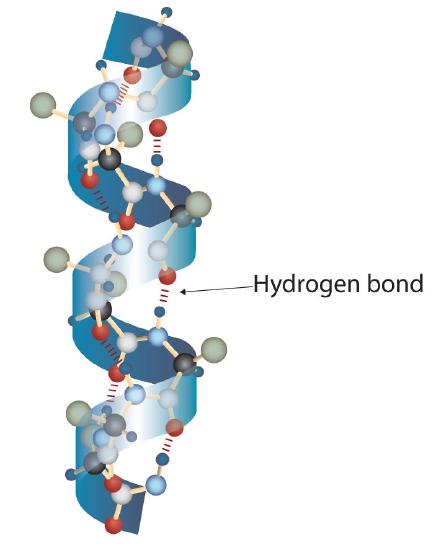
una molécula de proteína no es una maraña aleatoria de cadenas de polipéptidos. En cambio, las cadenas están dispuestas en conformaciones únicas pero específicas. El término estructura secundaria se refiere a la disposición fija de la columna vertebral del polipéptido., Sobre la base de estudios de rayos X, Linus Pauling y Robert Corey postularon que ciertas proteínas o porciones de proteínas se tuercen en una espiral o hélice. Esta hélice se estabiliza mediante un enlace de hidrógeno intrachain entre el átomo de oxígeno carbonilo de un aminoácido y el átomo de hidrógeno de amida cuatro aminoácidos en la cadena (ubicado en el siguiente giro de la hélice) y se conoce como una hélice α derecha. Los datos de rayos X indican que esta hélice hace un giro por cada 3.6 aminoácidos, y las cadenas laterales de estos aminoácidos se proyectan hacia afuera desde la columna vertebral en espiral (figura \(\PageIndex{2}\))., Las α-queratinas, que se encuentran en el cabello y la lana, son exclusivamente α-helicoidales en conformación. Algunas proteínas, como la gamma globulina, la quimotripsina y el citocromo c, tienen poca o ninguna estructura helicoidal. Otros, como la hemoglobina y la mioglobina, son helicoidales en ciertas regiones, pero no en otras.
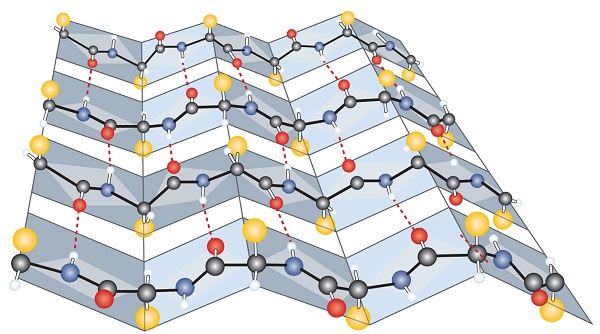
otro tipo común de estructura secundaria, llamada conformación de hoja plisada β, es una disposición similar a una hoja en la que dos o más cadenas de polipéptidos extendidas (o regiones separadas en la misma cadena) están alineadas una al lado de la otra. Los segmentos alineados pueden correr paralelos o antiparalelos, es decir, los terminales N pueden mirar en la misma dirección en cadenas adyacentes o en diferentes direcciones, y están conectados por enlaces de hidrógeno entre cadenas (figura \(\PageIndex{3}\))., La lámina plisada β es particularmente importante en proteínas estructurales, como la fibroína de seda. También se ve en porciones de muchas enzimas, como la carboxipeptidasa A y la lisozima.
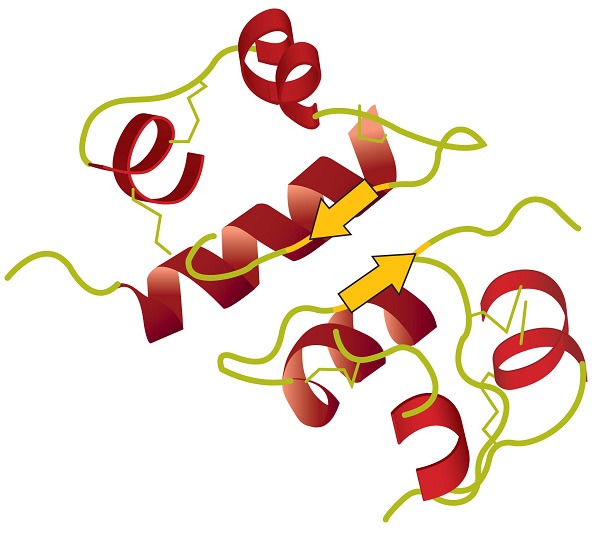
La estructura terciaria se refiere a la forma tridimensional única de la proteína en su conjunto, que resulta del plegado y doblado de la columna vertebral de la proteína. La estructura terciaria está íntimamente ligada al correcto funcionamiento bioquímico de la proteína. La figura \(\PageIndex{4}\) muestra una representación de la estructura tridimensional de la insulina.
cuatro tipos principales de interacciones atractivas determinan la forma y la estabilidad de la estructura terciaria de las proteínas. Estudiaste varios de ellos anteriormente.
- unión Iónica. Los enlaces iónicos resultan de las atracciones electrostáticas entre las cadenas laterales de aminoácidos cargadas positiva y negativamente., Por ejemplo, la atracción mutua entre un ion carboxilato de ácido aspártico y un ion lisina amonio ayuda a mantener un área doblada particular de una proteína (parte (a) de la figura \(\PageIndex{5}\)).
- enlace de hidrógeno. El enlace de hidrógeno se forma entre un átomo de oxígeno altamente electronegativo o un átomo de nitrógeno y un átomo de hidrógeno unido a otro átomo de oxígeno o un átomo de nitrógeno, como los que se encuentran en las cadenas laterales de aminoácidos polares., El enlace de hidrógeno (así como las atracciones iónicas) es extremadamente importante tanto en las interacciones intra como intermoleculares de las proteínas (Parte (b) de la figura \(\PageIndex{5}\)).
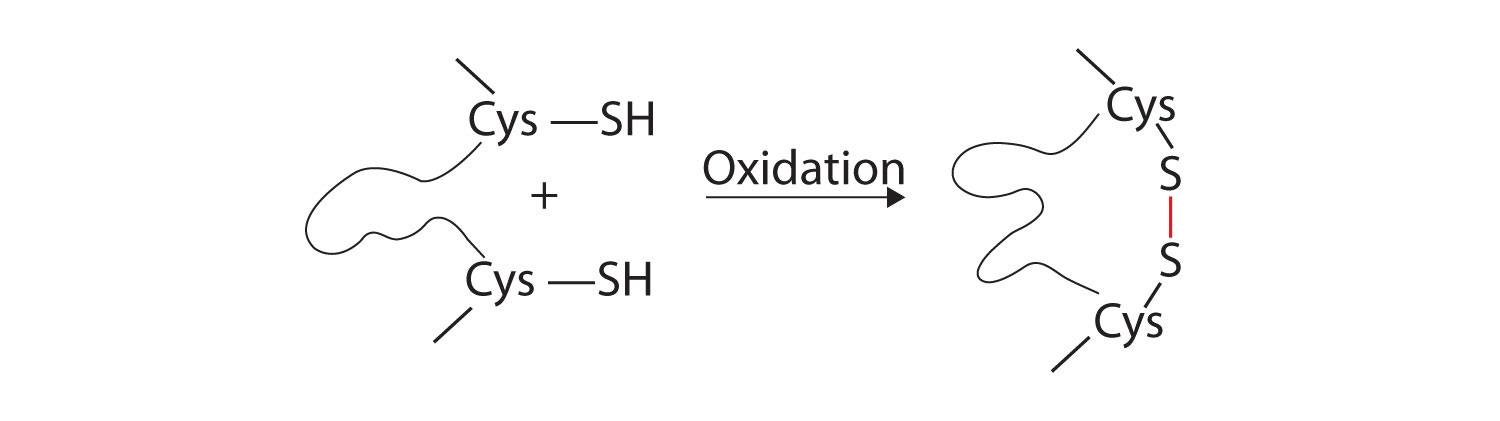
- disulfide linkages. Dos unidades de aminoácidos de cisteína se pueden acercar a medida que la molécula de proteína se pliega. La posterior oxidación y unión de los átomos de azufre en los grupos sulfhidrilo (SH) altamente reactivos conduce a la formación de cistina (Parte (c) de la figura \(\PageIndex{5}\))., Los enlaces disulfuro Intrachain se encuentran en muchas proteínas, incluyendo la insulina (barras amarillas en la figura \(\PageIndex{1}\)) y tienen un fuerte efecto estabilizador en la estructura terciaria.
- la Dispersión de fuerzas. Las fuerzas de dispersión surgen cuando un átomo normalmente no polar se vuelve momentáneamente polar debido a una distribución desigual de electrones, lo que conduce a un dipolo instantáneo que induce un desplazamiento de electrones en un átomo no polar vecino., Las fuerzas de dispersión son débiles pero pueden ser importantes cuando faltan otros tipos de interacciones o son mínimas (Parte (d) de la figura \(\PageIndex{5}\)). Este es el caso de la fibroína, la proteína principal en la seda, en la que una alta proporción de aminoácidos en la proteína tienen cadenas laterales no polares. El término interacción hidrofóbica es a menudo mal utilizado como sinónimo de fuerzas de dispersión. Las interacciones hidrofóbicas surgen porque las moléculas de agua participan en enlaces de hidrógeno con otras moléculas de agua (o grupos en proteínas capaces de enlaces de hidrógeno)., Debido a que los grupos no polares no pueden participar en la Unión de hidrógeno, la proteína se pliega de tal manera que estos grupos están enterrados en la parte interior de la estructura de la proteína, minimizando su contacto con el agua.
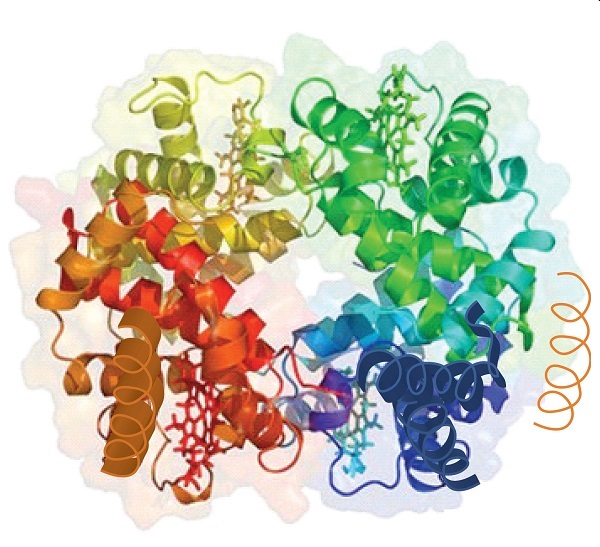
Cuando una proteína contiene más de una cadena de polipéptidos, cada cadena se denomina subunidad. La disposición de múltiples subunidades representa un cuarto nivel de estructura, la estructura cuaternaria de una proteína. La hemoglobina, con cuatro cadenas o subunidades polipeptídicas, es el ejemplo más frecuentemente citado de una proteína con estructura cuaternaria (figura \(\PageIndex{6}\))., La estructura cuaternaria de una proteína es producida y estabilizada por los mismos tipos de interacciones que producen y mantienen la estructura terciaria. Una representación esquemática de los cuatro niveles de la estructura proteica está en la figura \(\PageIndex{7}\).
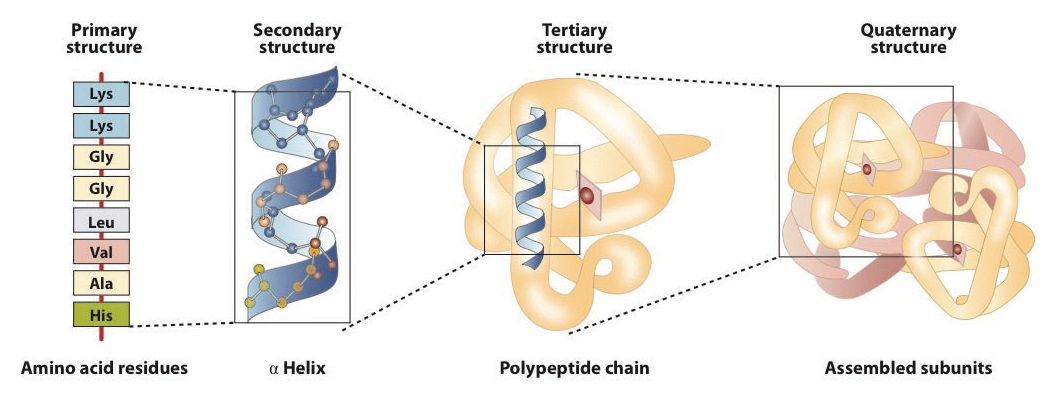
la estructura primaria consiste en la secuencia específica del aminoácido. La cadena peptídica resultante puede torcerse en una hélice α, que es un tipo de estructura secundaria. Este segmento helicoidal se incorpora a la estructura terciaria de la cadena polipeptídica plegada., La cadena polipeptídica única es una subunidad que constituye la estructura cuaternaria de una proteína, como la hemoglobina que tiene cuatro cadenas polipeptídicas.