el estado de oxidación de un átomo es la carga de este átomo después de la aproximación iónica de sus enlaces heteronucleares. El número de oxidación es sinónimo del Estado de oxidación. Determinar los números de oxidación a partir de la estructura de Lewis (figura 1a) es incluso más fácil que deducirlo de la Fórmula molecular (figura 1B). El número de oxidación de cada átomo se puede calcular restando la suma de pares solitarios y electrones que gana de los enlaces del número de electrones de Valencia., Los enlaces entre átomos del mismo elemento (enlaces homonucleares) siempre se dividen por igual.
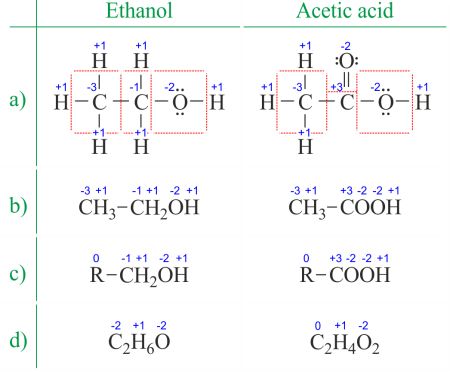
cuando se trata de compuestos orgánicos y fórmulas con múltiples átomos del mismo elemento, es más fácil trabajar con fórmulas moleculares y números de oxidación promedio (figura 1d). Los compuestos orgánicos se pueden escribir de tal manera que cualquier cosa que no cambie antes del primer enlace C-C Se reemplace con la abreviatura R (figura 1C). A diferencia de los radicales en moléculas orgánicas, R no puede ser hidrógeno. Dado que los electrones entre dos átomos de carbono se distribuyen uniformemente, el grupo R no cambia el número de oxidación del átomo de carbono al que está unido., Puede encontrar ejemplos de uso en la página dividir la reacción redox en dos semirreacciones.
reglas para asignar números de oxidación
- El número de oxidación de un elemento libre es siempre 0.
- El número de oxidación de un ion monatómico es igual a la carga del ion.
- al flúor en los compuestos siempre se le asigna un número de oxidación de -1.
- Los metales alcalinos (Grupo I) siempre tienen un número de oxidación de + 1.
- a los metales alcalinotérreos (Grupo II) siempre se les asigna un número de oxidación de +2.,
- El oxígeno casi siempre tiene un número de oxidación de -2, excepto en peróxidos (H2O2) donde es -1 y en compuestos con flúor (OF2) donde es +2.
- El hidrógeno tiene un número de oxidación de +1 cuando se combina con no metales, pero tiene un número de oxidación de -1 cuando se combina con metales.
- La suma algebraica de los números de oxidación de los elementos en un compuesto es cero.
- La suma algebraica de los estados de oxidación en un ion es igual a la carga en el ion.