fisiología normal de la aldosterona
la aldosterona participa en la homeostasis del volumen sanguíneo circulante y la concentración de potasio sérico; estos, a su vez, se retroalimentan para regular la secreción de aldosterona por la zona glomerulosa de la corteza suprarrenal. La secreción de aldosterona es estimulada por un agotamiento real o aparente en el volumen sanguíneo detectado por los receptores de estiramiento y por un aumento en las concentraciones séricas de iones de potasio; se suprime por hipervolemia e hipopotasemia.,
los mecanismos que regulan la secreción de aldosterona son complejos, involucrando la zona glomerulosa de las glándulas suprarrenales, el aparato yuxtaglomerular en los riñones, el sistema cardiovascular, el sistema nervioso autónomo, los pulmones y el hígado (vea la imagen a continuación). Los principales factores que estimulan la producción y liberación de aldosterona por la zona glomerulosa son la angiotensina II y la concentración sérica de potasio. El aparato yuxtaglomerular es el principal sitio de regulación de la producción de angiotensina II.,
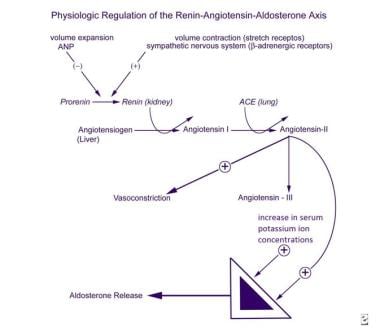 regulación Fisiológica del sistema renina-angiotensina-aldosterona eje.
regulación Fisiológica del sistema renina-angiotensina-aldosterona eje. la ACTH estimula la secreción de aldosterona de manera aguda y transitoria, pero no parece desempeñar un papel significativo en la regulación a largo plazo de la secreción mineralocorticoide. Los principales inhibidores de la zona glomerulosa incluyen el péptido natriurético auricular circulante (ANP) y, localmente, la dopamina., Aunque los niveles de ANP están claramente aumentados en hiperaldosteronismo, ni la ANP ni la dopamina han sido implicadas como causa primaria de secreción de aldosterona clínicamente desordenada.
se ha demostrado que la metoclopramida aumenta la secreción de aldosterona, lo que sugiere que la dopamina puede inhibir tónicamente la liberación de aldosterona. Las funciones fisiológicas de la adrenomedulina y del péptido intestinal vasoactivo (VIP) en la secreción de aldosterona siguen sin aclararse, aunque ambos neuropéptidos se producen en la zona glomerulosa de la rata.,
la síntesis de prorenina, su conversión a renina y su secreción sistémica son estimuladas por la contracción del volumen sanguíneo detectada por los receptores de estiramiento, la estimulación beta-adrenérgica del sistema nervioso simpático y las prostaglandinas I2 y E2. Estos procesos son inhibidos por la expansión de volumen y ANP.
la renina convierte el angiotensinógeno, una proenzima sintetizada en el hígado, en el decapéptido angiotensina I, que luego se convierte en los pulmones en el octapéptido angiotensina II por la enzima convertidora de angiotensina (ECA)., La angiotensina II es tanto un estimulador de la secreción de aldosterona como un potente vasopresor. La angiotensina II se metaboliza a angiotensina III, un heptapéptido que también es un estimulador de la secreción de aldosterona.
la síntesis y secreción de prostaglandinas I2 y E2 y la función normal de los receptores de estiramiento dependen de la concentración de calcio ionizado intracelular. La secreción Renal de prostaglandinas es estimulada por las catecolaminas y la angiotensina II., La compleja regulación de la síntesis y secreción de aldosterona proporciona varios puntos en los que puede ocurrir una alteración en la regulación de la secreción de aldosterona.
la aldosterona se sintetiza a partir del colesterol en una serie de 6 pasos biosintéticos (ver la imagen de abajo). Solo los últimos 2 pasos son específicos para la síntesis de aldosterona; los primeros 4 también se aplican a la síntesis de cortisol por la zona fasciculata. En consecuencia, un defecto en una de las enzimas sintéticas específicas de aldosterona no conduce a hipercortisolismo e hiperplasia suprarrenal secundaria mediada por ACTH.,
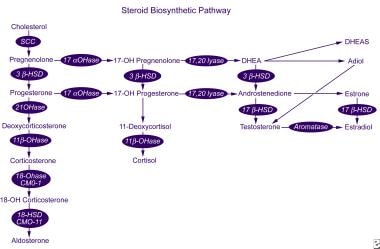 Esteroides vía biosintética.
Esteroides vía biosintética. la enzima aldosterona sintasa está codificada por el gen CYP11B2 y tiene actividad de 11β-hidroxilasa, 18-hidroxilasa y 18-hidroxidehidrogenasa. Este gen se encuentra en el cromosoma humano arm 8q24.3-tel, cerca del gen CYP11B1, que codifica 11β-hidroxilasa, la enzima que cataliza el paso final de la síntesis de cortisol. Las mutaciones en estos genes pueden dar lugar a una serie de trastornos de la síntesis de aldosterona (ver diferenciales).,
La acción de la aldosterona sobre los tejidos diana (por ejemplo, el túbulo renal distal, las glándulas sudoríparas, las glándulas salivales y el epitelio del intestino grueso) está mediada por un receptor mineralocorticoide específico. Los receptores mineralocorticoides exhiben igual afinidad por los mineralocorticoides y el cortisol, sin embargo, los receptores de aldosterona en el túbulo distal y en otros lugares están protegidos de la activación mediada por el cortisol por 11β-hidroxisteroide deshidrogenasa tipo 2, que convierte localmente el cortisol en cortisona inactiva.,
aldosteronismo primario
el término hiperaldosteronismo primario (o aldosteronismo primario ) se refiere a un aumento independiente de la renina en la secreción de aldosterona. Esta condición es principalmente una enfermedad de la edad adulta, con su incidencia máxima en la cuarta a sexta décadas de la vida.
más del 90% de los casos de AP se deben a un adenoma productor de aldosterona (APA), que representa alrededor del 35% de los casos (30-40%), o al hiperaldosteronismo idiopático (IHA), que representa alrededor del 60% de los casos (casi todos bilaterales)., La hiperplasia suprarrenal Unilateral (AHU) es una causa rara de AP, que representa el 1-2% de los casos. Cerca de 1% de los pacientes se presentan con carcinomas adrenocorticales que son puramente secretores de aldosterona y suelen ser grandes en el momento del diagnóstico; 1% se presentan con hiperaldosteronismo familiar y 1% se presentan con un adenoma o carcinoma ectópico que produce aldosterona.
la hiperplasia suprarrenal Unilateral representa el 14-17% de todos los casos de AP unilateral. La prevalencia de adenoma cortical dentro de la hiperplasia cortical se estima en 6-24%., La presentación clínica y el desenlace de los pacientes con hiperaldosteronismo primario unilateral son similares independientemente del diagnóstico histopatológico. La hiperplasia adrenocortical Unilateral es poco frecuente.
Los APAs (a veces denominados aldosteronomas) suelen ser adenomas encapsulados benignos de menos de 2 cm de diámetro. La mayoría de los casos son solitarios, aunque en hasta un tercio de los casos, existe evidencia de nodularidad en la misma glándula suprarrenal, lo que sugiere que la condición ha surgido en una glándula previamente hiperplásica.,
Los pacientes con IHA tienen engrosamiento bilateral y nodularidad variable de su corteza suprarrenal. Existe un amplio espectro de gravedad para este trastorno, que puede pasar desapercibido durante largos períodos sin hipopotasemia y solo hipertensión leve. Se ha sugerido que la IHA surge como resultado de un factor estimulante de la corteza suprarrenal no detectado. Alternativamente, el trastorno puede surgir como resultado de una mutación activadora en un gen específico de la corteza suprarrenal. Ninguna de las hipótesis ha sido probada.,
las formas hereditarias de hiperaldosteronismo primario representan solo el 1% de los casos, pero es más probable que ocurran durante los años de infancia. Estas formas incluyen hiperaldosteronismo familiar (HF) tipos I, II y III.
hiperaldosteronismo Familiar Tipo I
FH tipo I (FH-I), también conocido como aldosteronismo remediable con glucocorticoides (GRA), se puede detectar en individuos asintomáticos durante la detección de la descendencia de los individuos afectados, o los pacientes pueden presentar en la infancia retraso del crecimiento debido a hipopotasemia., La FH – I se hereda de manera autosómica dominante y tiene una baja frecuencia de nuevas mutaciones.
La primera descripción clínica de GRA apareció en 1966, y el mecanismo genético fue descubierto en 1992. La FH-I surge como resultado del cruce desigual de CYP11B1 (el gen de la 11β-hidroxilasa) y CYP11B2 (el gen de la aldosterona sintasa) altamente relacionados durante la meiosis, produciendo un producto de fusión Tipo Anti-Lepore., Este reordenamiento genético hace que la expresión de CYP11B2 se coloque bajo el control del promotor de CYP11B1 y que la síntesis de aldosterona se regule anormalmente por ACTH en lugar de por el sistema renina-angiotensina.
el resultado es la producción de aldosterona dependiente de ACTH y la producción de análogos 17-hidroxilados de 18-hidroxicortisol bajo regulación de ACTH a partir de la expresión enzimática ectópica en la zona fasciculata. Se produce hiperplasia Bilateral de la zona fasciculata, y aparecen altos niveles de nuevos 18-hidroxiesteroides en la orina., La formación de adenomas es poco frecuente, pero los pacientes tienen un aumento significativo en la incidencia de aneurismas cerebrovasculares, para los cuales requieren exámenes de detección.
hiperaldosteronismo Familiar Tipo II
La HF tipo II (FH-II) es una forma hereditaria no glucocorticoide–supressible de hiperaldosteronismo que fue reconocida por primera vez como una entidad distinta por Gordon et al, aunque los casos habían sido descritos previamente en la década de 1980. En contraste con FH-I, algunos parientes de FH-II exhiben una alta tasa de formación de adenoma.,
aún no se han identificado el mecanismo y el locus génico, aunque se han excluido el CYP11B y los genes receptores de renina y angiotensina II. Sin embargo, se ha establecido un vínculo para varias familias con la banda 7p22. También se ha especulado que FH-II no es un solo trastorno.
hiperaldosteronismo Familiar Tipo III
La HF-III es una forma autosómica dominante rara de AP caracterizada por hipertensión de inicio temprano, hiperaldosteronismo remediable sin glucocorticoides e hipopotasemia., Las mutaciones heterocigotas missense de la línea germinal del gen KCNJ5, que codifica para Kir3.4, un miembro de la familia de canales K+ que rectifican internamente, se han identificado como una causa de FH-III.hasta el momento, se han reportado 4 mutaciones (G151R, G151E, T158A e I157S) en 6 familias.
el fenotipo clínico de los pacientes que albergan las mutaciones anteriores varía desde PA grave e hipertensión refractaria al tratamiento médico que requiere adrenalectomía bilateral, hasta hipertensión leve o moderada que responde a la terapia médica. En algunos pacientes se ha descrito hiperplasia suprarrenal.,
varios estudios de diferentes centros reportan una prevalencia de mutaciones somáticas de KCNJ5 en APAs esporádicas que varían de 30 a 65%. Hay 2 mutaciones recurrentes, G151R y L168R, notificadas en todos los estudios, mientras que hay un informe de una deleción de 3 nucleótidos, el delI157.
los residuos afectados tanto de la línea germinal como de las mutaciones somáticas se encuentran en o cerca del filtro de selectividad del canal de potasio Kir3.4 y están altamente conservados entre diferentes especies., Los estudios electrofisiológicos demuestran que estas mutaciones resultan en la pérdida de la selectividad del canal, con un aumento de la conductancia Na+ que conduce a la despolarización de la membrana. En las células de la zona glomerulosa, la despolarización de la membrana conduce a la apertura de los canales de Ca2+ activados por voltaje, con la activación de la vía de señalización de calcio, el principal mediador de la producción de aldosterona.
Los apa con mutaciones en KCNJ5 son más prevalentes en mujeres que en hombres y en pacientes más jóvenes. También se asocian con niveles más altos de aldosterona en el preoperatorio., No se relacionan con el tamaño del tumor, pero sí con niveles más altos de aldosterona y concentraciones más bajas de K+.
Los análisis de transcriptoma y reacción en cadena de la polimerasa (PCR) en tiempo real demuestran que los APAs con mutaciones KCNJ5 muestran una mayor expresión del gen CYP11B2 y su Regulador transcripcional NR4A2, aumentando así la producción de aldosterona. También se ha encontrado que los APAs con y sin mutaciones KCNJ5 muestran patrones de expresión génica ligeramente diferentes., En otro estudio se notificaron concentraciones de ARNm de KCNJ5 más altas en los APAs con mutaciones en KCNJ5 y significativamente más altas en los APA que en los adenomas y feocromocitomas productores de cortisol.
mutaciones somáticas en ATP1A1 (gen que codifica la subunidad alfa-1 de la ATPasa Na+ / K+, un miembro de la familia ATPasa de tipo P), ATP2B3 (gen que codifica la membrana plasmática que transporta el calcio ATPasa 3, otro miembro de la familia ATPasa de tipo P), O CACNA1D (gen que codifica Cav1.,3, la subunidad alfa de un canal de calcio controlado por voltaje de tipo L) están presentes en aproximadamente el 6%, 1% y 8% de todos los casos de un adenoma productor de aldosterona, respectivamente. Más recientemente, se notificaron mutaciones de novo de la línea germinal en CACNA1D en 2 niños con un síndrome no descrito previamente que presentaba PA y anomalías neuromusculares.,
hiperaldosteronismo secundario
hiperaldosteronismo secundario es un término colectivo para un grupo diverso de trastornos caracterizados por la activación fisiológica del eje renina-angiotensina-aldosterona (R-A-A) como un mecanismo homeostático diseñado para mantener las concentraciones de electrolitos en suero o el volumen de líquido. En presencia de una función renal normal, puede conducir a hipopotasemia.
el hiperaldosteronismo secundario se puede dividir en 2 categorías, 1 con hipertensión asociada y 1 sin ella., La primera categoría incluye hipertensión renovascular, que resulta de isquemia renal e hipoperfusión que conduce a la activación del eje R-A-A. Las causas más comunes de estenosis de la arteria renal en niños son la hiperplasia fibromuscular y la neurofibromatosis. La hipopotasemia puede ocurrir en hasta el 20% de los pacientes.
los niveles de actividad de renina plasmática (ARP) se encuentran a menudo en el rango de referencia, pero se pueden detectar niveles elevados de ARP después de la provocación con una dosis única de captopril 1 mg/kg., También se cree que la isquemia Renal subyace al hiperaldosteronismo secundario observado en la hipertensión maligna.
Hiperreninemia y aldosteronismo secundario también han sido reportados en pacientes con feocromocitoma, aparentemente como resultado de estenosis funcional de la arteria renal. Los tumores productores de renina son muy poco frecuentes y se observan concentraciones muy altas de ARP (hasta 50 ng/mL/h), con frecuencia con un aumento de la proporción de prorenina a renina. Los tumores son generalmente de origen renal e incluyen tumores de Wilms y carcinomas de células renales.,
la hiperpotasemia debida a insuficiencia renal crónica también causa hiperaldosteronismo secundario. Las proporciones bajas de sodio a potasio se pueden medir en la saliva y las heces. La hipertensión inducida por ciclosporina en pacientes con trasplante de órganos sólidos también puede implicar un componente de hiperaldosteronismo.
el hiperaldosteronismo secundario en ausencia de hipertensión ocurre como resultado de intentos homeostáticos para mantener la concentración de sodio o el volumen circulatorio o para reducir la concentración de potasio., Las condiciones clínicas en las que puede surgir incluyen diarrea, sudoración excesiva, estados de bajo gasto cardíaco e hipoalbuminemia debida a enfermedad hepática o renal o síndrome nefrótico. El hiperaldosteronismo secundario también puede ocurrir en el desarrollo de los bebés recién nacidos (ver a continuación).
aumento de la dependencia mineralocorticoide en los jóvenes
la dependencia mineralocorticoide de la reabsorción de sodio aumenta durante la infancia y la infancia, alcanzando un pico en el período neonatal antes de disminuir progresivamente con el avance de la edad., Este aumento se produce porque la reabsorción de sodio y agua por el túbulo proximal es menos eficiente en la vida temprana, lo que resulta en un aumento de la carga de sodio y agua a nivel del túbulo renal distal.
debido a que la reabsorción de sodio y agua del túbulo distal está mediada por el eje R-A-A, la ARP es aproximadamente 10 a 20 veces mayor en un recién nacido que en un ADULTO., En consecuencia, los neonatos muestran aumentos relativos en las tasas de producción de aldosterona (>300 µg/m2/día vs 50 µg/m2/día en un adulto) y concentraciones plasmáticas de aldosterona (80 PG/dL vs 16 pg/dL). Estos aumentos en la vida temprana explican por qué los bebés pequeños exhiben síntomas clínicos profundos de hiperaldosteronismo que mejoran gradualmente con la edad avanzada.