tendencias periódicas
Introducción
Los electrones se mantienen en un átomo o ion por la atracción electrostática entre el núcleo cargado positivamente y los electrones cargados negativamente. En las especies multielectrónicas, los electrones no experimentan la carga positiva completa del núcleo debido al blindaje de los electrones que se encuentran entre el electrón de interés y el núcleo. La cantidad de carga positiva que realmente actúa sobre un electrón se llama carga nuclear efectiva.,
carga nuclear efectiva
el concepto de carga nuclear efectiva (Z*) es importante para comprender las propiedades periódicas. La carga nuclear efectiva es la porción de la carga nuclear total que experimenta un electrón dado en un átomo. Esto es igual al número atómico (Z) menos la cantidad (σ) que otros electrones en el átomo protegen al átomo dado del núcleo.
Z* = z-σ
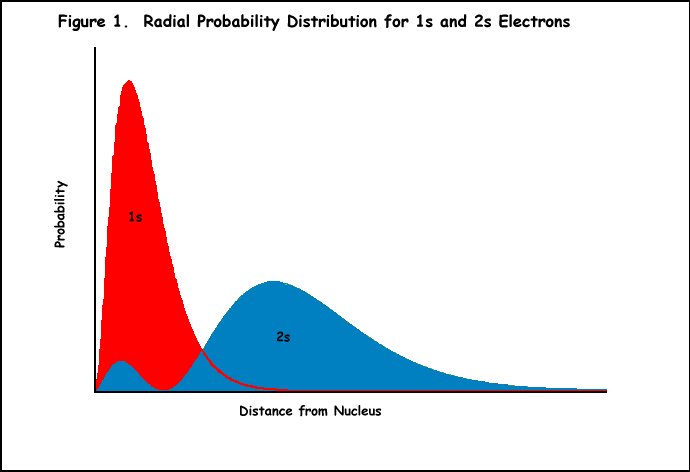
Ejemplo: El litio tiene tres protones y una configuración electrónica de 1s22s1., El electrón en el orbital 2s está protegido de la atracción completa de los protones por los electrones del orbital 1s (Figura 1). Por lo tanto, Z* sentido por el electrón 2s debe ser uno en lugar de tres. Sin embargo, el electrón 2S de litio no se comporta como si estuviera experimentando exactamente una carga +1 (Z* es en realidad alrededor de 1.3 unidades de carga). Esto puede explicarse por el hecho de que el orbital 2s tiene dos máximos en su función de probabilidad radial (Figura 1), y los máximos menores penetran dentro del máximo del electrón interno 1s., Aunque el electrón 2S de litio pasa la mayor parte de su tiempo en el lóbulo exterior de ese orbital sintiendo una carga nuclear de +1, parte del tiempo está dentro del orbital 1s experimentando la carga nuclear completa de +3. Por lo tanto, Z* es algo mayor que +1.
reglas de Slater para determinar σ
en 1930, J. S. Slater formuló el siguiente conjunto de reglas empíricas para determinar los valores de la constante de blindaje σ.,
-
escriba la configuración electrónica del elemento y agrupe los orbitales en el siguiente orden:
(1s)(2s, 2p)(3s, 3P)(3D)(4s, 4P)(4d)(4f)(5s, 5p)…….. - Para establecer la constante de cribado para cualquier electrón, Sume las siguientes contribuciones:
- Los electrones en grupos fuera (a la derecha) del que se está considerando no contribuyen al blindaje.
- Los electrones en el mismo grupo contribuyen 0.35 al blindaje (excepto el grupo 1s, donde una contribución de 0.,30 se utiliza
- Para los electrones S O p que se observan, cada electrón en la capa (n-1) contribuye 0.85 a la protección y cada electrón en la (n-2), (n-3), … las conchas contribuyen 1.00 al blindaje
- Para los electrones D O f que se observan, cada electrón en un grupo subyacente contribuye 1.00 al blindaje.,
Ejemplo: calcular Z* para un electrón 4s y un electrón 3d en Zn
determinar la configuración electrónica para Zn
(1s)2(2s, 2p)8(3S, 3P)8(3d)10(4S)2
para un electrón 4s:
establecer la constante de detección para el electrón 4S
σ = (1 x 0.35) + (18 x 0.85) + (10×1.00) = 25.65
calcular la carga nuclear efectiva
z*= z-σ = 30-25.65 = 4.,35
para un electrón 3d:
establecer la constante de detección para el electrón 3D ![]()
calcular la carga nuclear efectiva![]()
a partir de este ejemplo, puede ver que los electrones 3d experimentan una carga positiva mucho mayor que el electrón 4s y se sostendrían más firmemente. Por lo tanto, los electrones 4s serán los primeros eliminados cuando Zn Se ionice.,
- usando las reglas de Slater, calcule un valor para la carga nuclear efectiva sentida por (a) un electrón que se agrega al orbital 3s de un átomo de neón electrón ionizado del Orbital 2p del átomo de neón.
 comente sus resultados relativos a la estabilidad de la configuración electrónica del átomo de neón.,
comente sus resultados relativos a la estabilidad de la configuración electrónica del átomo de neón.,
- Calcule Z * para los electrones de Valencia en los átomos Li A Ne usando (a) la suposición de que σ es igual al número de electrones de la capa interna y (b) las reglas de Slater. Trazar ambos conjuntos de resultados en el mismo gráfico y discutir.
- recordar por qué la energía de un orbital ns es menor que la de un orbital np. Utilice esta información para discutir la suposición de que estos orbitales siempre se consideran como un grupo (ns, np) en las reglas de Slater.
- La gráfica de la probabilidad de encontrar electrones 3s, 3P, 3D y 4s como una función de la distancia radial desde el núcleo se puede ver aquí., Discuta estas probabilidades en relación con las reglas 2c y 2d de las reglas de Slater.
Puede acceder a una hoja de cálculo para calcular cargas nucleares efectivas aquí. Si necesita ayuda para usar Excel para trazar datos, pruebe este tutorial.
la Tabla periódica
usted ha utilizado la Tabla periódica a lo largo de su estudio de química. Lea más sobre la Tabla periódica aquí. Mendeleev fue uno de los primeros químicos en reconocer que las propiedades de los elementos eran de naturaleza periódica. Lea de la publicación original de Mendeleev.,
tendencias periódicas
en el resto de este módulo, analizarás las tendencias periódicas que existen entre los elementos. Comience su investigación viendo esta película sobre tendencias periódicas.,
Radio atómico
Hay varias maneras de definir el radio atómico de un átomo:
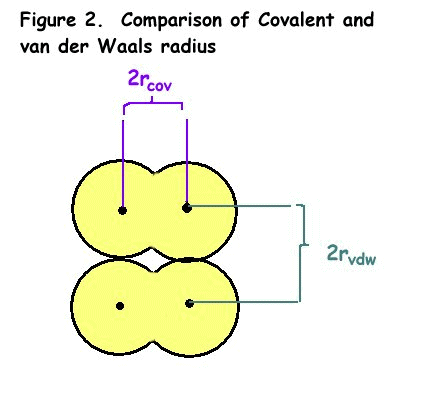
- radio covalente (rcov), la media distancia entre los núcleos de dos átomos unidos en un enlace covalente
- radio de van der Waals (rvdw), la media distancia entre los núcleos de dos átomos de moléculas vecinas
- radio metálico (rmet), para elementos metálicos, la media distancia entre los núcleos de dos átomos vecinos en el metal sólido
la diferencia entre el radio covalente y el radio de Van der Waals se muestra en la figura 2.,
- graficar los valores de los radios vs número atómico para el Grupo 1A elementos y el Período de 2 elementos. encontrará
 los datos que necesita en esta hoja de cálculo de Excel de datos de propiedades físicas para los elementos (haciendo clic derecho en el enlace le permitirá guardar el archivo).
los datos que necesita en esta hoja de cálculo de Excel de datos de propiedades físicas para los elementos (haciendo clic derecho en el enlace le permitirá guardar el archivo).
- Use el concepto de carga nuclear efectiva para racionalizar la tendencia en los valores de radios para los elementos del grupo 1A.,
- Use el concepto de carga nuclear efectiva para racionalizar la tendencia en los valores de radios para el período 2 elementos.
puede ver una película corta que representa lo que debería haber concluido aquí.
energía de ionización
recuerde que la energía de ionización (en realidad la primera energía de ionización) es la energía requerida para eliminar un electrón del orbital ocupado más externo de un átomo gaseoso.
- Trace las energías de ionización para los primeros 86 elementos de la Tabla periódica versus el número atómico.,
 muestre su gráfico como un gráfico normal y como un gráfico de barras. Explicar las tendencias generales que ocurren a lo largo de un período y de una familia utilizando el concepto de carga nuclear efectiva. En cada período ocurre una anomalía a la tendencia general con el elemento del grupo 3A y el elemento del grupo 6A. Explica este comportamiento anómalo.
muestre su gráfico como un gráfico normal y como un gráfico de barras. Explicar las tendencias generales que ocurren a lo largo de un período y de una familia utilizando el concepto de carga nuclear efectiva. En cada período ocurre una anomalía a la tendencia general con el elemento del grupo 3A y el elemento del grupo 6A. Explica este comportamiento anómalo. - usando las reglas de Slater, calcula la Z* para Al, Al+, Al2+ y Al3+. Discuta los resultados relativos a las energías de ionización esperadas para estas especies.,
- Calcule el Z* para el electrón de Valencia ns de litio, sodio y potasio utilizando la suposición de que σ es igual al número de electrones de la capa interna. ¿Son sus resultados consistentes con las tendencias en energía de ionización para estos elementos? Discuta por qué o por qué no.
afinidad electrónica
la afinidad electrónica es el cambio en la energía que ocurre cuando un electrón se agrega a un átomo gaseoso neutro.
trace la afinidad electrónica para los elementos del Grupo Principal ( Grupo 1A-8A) versus el número atómico., muestre su gráfico como un gráfico normal y como un gráfico de barras. Explicar las tendencias generales que ocurren a lo largo de un período y de una familia utilizando el concepto de carga nuclear efectiva. Una anomalía a la tendencia general ocurre en un período al pasar del elemento del grupo 1A al elemento del grupo 2a y al pasar del grupo 4A al grupo 5A. una anomalía también se puede encontrar entre las filas 2 y 3 al bajar un período. Dar una explicación para cada una de estas anomalías.,
muestre su gráfico como un gráfico normal y como un gráfico de barras. Explicar las tendencias generales que ocurren a lo largo de un período y de una familia utilizando el concepto de carga nuclear efectiva. Una anomalía a la tendencia general ocurre en un período al pasar del elemento del grupo 1A al elemento del grupo 2a y al pasar del grupo 4A al grupo 5A. una anomalía también se puede encontrar entre las filas 2 y 3 al bajar un período. Dar una explicación para cada una de estas anomalías.,
electronegatividad
electronegatividad es la capacidad de un átomo en una molécula para atraer electrones hacia sí mismo.
 Bosqueje una tabla periódica, indicando la tendencia de electronegatividades de Menor a mayor. Relacionar estas tendencias con la carga nuclear efectiva y el tamaño atómico.
Bosqueje una tabla periódica, indicando la tendencia de electronegatividades de Menor a mayor. Relacionar estas tendencias con la carga nuclear efectiva y el tamaño atómico.
otras tendencias
Hay muchas propiedades para las que puede investigar tendencias periódicas. Hay una buena hoja de cálculo de Excel que le permite ver las tendencias de varias propiedades en 3-D., Descargue la hoja de cálculo. Esta hoja de cálculo utiliza macros para acceder a las parcelas. Si recibe un mensaje de que las macros no se han descargado debido a la configuración de seguridad, restablezca la configuración de seguridad para Excel mediante el menú Herramientas. Deberá habilitar la edición y, si se le solicita, convertirlo en un documento de confianza.
![]()