Introducción
la fiebre Chikungunya es una enfermedad viral transmitida a través de la picadura de mosquitos Aedes infectados. La enfermedad típicamente consiste en una enfermedad aguda con fiebre, erupción cutánea y artralgia incapacitante. La palabra chikungunya significa «caminar encorvada» en el dialecto Africano Makonde, y se refiere al efecto de la abulia artralgia visto en los pacientes afectados.1 el virus Chikungunya (CHIKV) es el agente etiológico y un miembro del género Alphavirus en la familia Togaviridae.,2
los casos de Chikungunya ocurren en África, Asia y el subcontinente indio. Las infecciones humanas en África se han mantenido en niveles relativamente bajos durante varios años. En diciembre de 2013, Francia reportó 2 casos autóctonos confirmados por laboratorio en la parte francesa de la isla caribeña de San Martín. Desde entonces, la transmisión local se ha confirmado en más de 43 países y territorios de la región Americana.3 Este fue el primer brote documentado de CHIKV con transmisión autóctona en las Américas, por lo que es motivo de gran preocupación en nuestro continente.,
genoma, estructura y replicación del CHIKV
el virus Chikungunya es un virus ARN de cadena Plus envuelto con simetría icosaédrica. El virión tiene un diámetro de 70 NM y está compuesto por unidades repetitivas de las glicoproteínas transmembranas E1 y E2 (240 heterodímeros de E2/E1 dispuestos como picos triméricos en su superficie), la cápside (C), una bicapa lipídica derivada del huésped y una sola molécula de ARN del genoma.4 El genoma tiene aproximadamente 12kb de longitud y codifica las proteínas no estructurales (nsPs) en el extremo 5′ y las proteínas estructurales en el extremo 3′., Los NSP se traducen a partir del ARN genómico y las proteínas estructurales a partir de un ARN subgenómico (Fig. 1).5
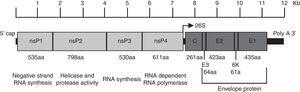
organización del genoma del virus chikungunya. La figura muestra las proteínas no estructurales y estructurales de la forma en que se organizan a lo largo del genoma, así como las regiones no traducibles en 5′ y 3′. Se muestra la función y el tamaño de los aminoácidos para cada proteína. La figura se dibuja a escala basada en el genoma de CHIKV con el número de acceso de GenBank: AM258990., Los tamaños de las regiones no traducibles se obtuvieron de Hyde et al.92 la figura fue adaptada de Weaver61 y Solignat.93 NSP: proteína no estructural; C: cápside; e: envolvente; AA: aminoácido.
Alfavirus entrar destino de las células por endocitosis. Algunos receptores (DC-SIGN, L-SIGN, sulfato de heparina, laminina e integrinas) se han implicado en este proceso, pero sus funciones precisas no se han demostrado claramente.5 recientemente, prohibitin fue identificado como proteína del receptor de CHIKV.,6 Después de la endocitosis, el ambiente ácido del endosoma desencadena cambios conformacionales en la envoltura viral que exponen el péptido E1, que media la fusión de la membrana de la célula virus–huésped. Esto permite la entrega citoplasmática del núcleo y la liberación del genoma viral. Dos precursores de proteínas no estructurales se traducen del ARNm viral, y la escisión de estos precursores genera nsp1-nsP4.7 estas proteínas se ensamblan para formar el complejo de replicación viral, que sintetiza un intermediario de ARN de cadena negativa de longitud completa., Esto sirve como plantilla para la síntesis de ARN subgenómicos (26S) y genómicos (49S). El ARN subgenómico impulsa la expresión del precursor de la poliproteína C-pE2-6K-E1, que es procesado por autoprotólisis. La cápside se libera, y el procesamiento posterior genera las glicoproteínas pE2 y E1. PreE2 y E1 se asocian en el Golgi y se exportan a la membrana plasmática, donde pE2 se divide en E2 y E3. La Unión de la nucleocápsida viral al ARN viral y el reclutamiento de las glicoproteínas de la envoltura asociadas a la membrana promueven el ensamblaje viral., La partícula alphavirus ensamblada, con un núcleo icosaédrico, capulla en la membrana celular.5,7
vectores, transmisión y reservorios
Se han documentado dos ciclos de transmisión distintos: el enzoótico y el urbano. En África, un ciclo enzoótico ocurre en hábitats boscosos donde los mosquitos arbóreos, principalmente Aedes spp, sirven como vectores. La evidencia apunta a los primates no humanos como el principal reservorio y huésped de amplificación en el ciclo enzoótico basado en sus altas tasas de seroprevalencia, infección documentada y viremia en la naturaleza, y niveles de viremia en respuesta a la infección experimental.,8
el ciclo de transmisión enzoótica puede extenderse para infectar a las personas que viven cerca, y los vectores de mosquitos enzoóticos pueden estar involucrados en la transmisión interhumana durante pequeños brotes. Las epidemias también ocurren en África cuando el CHIKV se introduce en áreas urbanas donde los vectores más antropófilos, Aedes aegypti y Aedes albopictus, pueden iniciar la transmisión humano–mosquito–humano.
CHIKV es capaz de iniciar un ciclo de transmisión urbano sostenido que depende solo de A. aegypti y / o A. albopictus y huéspedes de amplificación humana.,9 Este ciclo endémico / epidémico da como resultado altos niveles de exposición humana a la transmisión de mosquitos, particularmente porque estos vectores viven muy cerca de las personas.
el comportamiento y la ecología de A. aegypti, en particular, son ideales para la transmisión epidémica porque las hembras adultas prefieren alimentarse de humanos, a menudo toman varias comidas parciales de sangre durante un solo ciclo gonotrófico, ovipositan en contenedores artificiales como sus sitios larvarios preferidos, y descansan dentro de casas con fácil acceso a huéspedes humanos.10
A., albopictus es zoofílico y antropofílico, agresivo, silencioso, activo durante todo el día, y tiene una vida útil más larga que otros mosquitos (hasta 8 semanas). En las últimas décadas se ha expandido a varias áreas previamente conocidas por estar libres de Aedes.11,12 parece que la mayoría de las nuevas introducciones de A. albopictus han sido causadas por huevos vegetativos contenidos en madera y neumáticos exportados de Asia a todo el mundo.13
aunque la infectividad de varias cepas de CHIKV varía ampliamente tanto para A. aegypti como para A., albopictus, los seres humanos desarrollan viremias de títulos altos que generalmente persisten durante los primeros 4 días después de la aparición de los síntomas, con el pico estimado en el día de inicio en aproximadamente 109 RNAcopies virales/ml14 y títulos infecciosos que a veces exceden 107PFU/ml.15 estos títulos generalmente superan los niveles de dosis infecciosa oral del 50% para ambas especies portadoras epidémicas, lo que permite una transmisión eficiente entre los seres humanos por mosquitos.16
los seres humanos sirven como el principal reservorio de CHIKV durante los períodos epidémicos., Fuera de estos períodos, los monos, roedores y aves constituyen el reservorio del virus que sostiene la circulación del virus en el medio ambiente en ausencia de casos humanos.17,18
Distribución geográfica
el CHIKV se encuentra típicamente siendo transmitido en África y el Sudeste Asiático. Desde su descubrimiento en 1952, el CHIKV ha causado varias epidemias en estos lugares.19,20
El último brote enorme comenzó en Kenia en 2004 y se propagó a través de las islas vecinas a la reunión en 2005.21 después de eso, el virus se propagó a varias islas en el Océano Índico y la India.,1,22 desde la India se extendió a Sri Lanka, Tailandia, Malasia y finalmente a Italia en 2007.23, 24 en 2009 la transmisión del CHIKV se reinició en la reunión y condujo a la reimportación del CHIKV a Europa en mayo de 2010.25
durante 2011, el CHIKV se transmitió en Oceanía, África Central, Asia meridional y sudoriental, Europa y las Islas Occidentales del Océano Índico. En 2012, se notificó CHIKV en: Asia sudoriental, Meridional y occidental; Oceanía; África Central y occidental; e Islas del Océano Índico occidental. Durante 2013, el CHIKV se transmitió en el Sudeste, Sur y este de Asia y Oceanía.,20
el brote actual comenzó en la isla caribeña de San Martín el 6 de diciembre de 2013.26 durante diciembre de 2013 y enero de 2014 se extendió a las islas vecinas.27 en febrero, continuó extendiéndose y llegó a la Guayana Francesa.28 en mayo, Guayana y casi todas las Islas del Caribe reportaron infecciones autóctonas de CHIKV.29 en junio, se reportaron los primeros casos de El Salvador.30 en julio, se reportó transmisión autóctona en Florida, EE.UU., Costa Rica, Panamá y Venezuela.31 En septiembre, se habían reportado casos en Guatemala, Colombia y Brasil.,32 en octubre, Nicaragua y Paraguay reportaron casos por primera vez y los casos Guatemaltecos aumentaron.33 A finales de noviembre, México reportó su primera transmisión autóctona en el estado sureño de Chiapas. También Este mes, Belice y Honduras reportaron casos.34
según la Organización Panamericana de la Salud (OPS), desde el inicio del brote actual, se han registrado 1.280.953 casos sospechosos de transmisión autóctona y se han confirmado más de 26.300 en América.35 los informes recientes obtenidos de México revelan 405 transmisiones autóctonas confirmadas.,35 Sin embargo, estas cifras no incluyen a los pacientes que no buscaron ayuda médica.
filogenia
Hay cuatro linajes CHIKV identificados, cada uno con características genotípicas y antigénicas distintas. El primer estudio filogenético reveló que el CHIKV se propagó desde África, donde circularon dos linajes principales: África Occidental y África Oriental / Central / Sudafricana (ECSA). Posteriormente, el linaje ECSA se extendió a Asia y originó el linaje Asiático.36,37 hasta 2004, estos eran los únicos linajes CHIKV identificados que circulaban., La fuente de la epidemia del Océano Índico de 2005 se remonta al linaje ECSA.38 cuando la epidemia del Océano Índico comenzó en Kenia en 2004, los primeros aislados de CHIKV de la epidemia de la reunión exhibieron una alanina en el residuo de proteína de la envoltura E1 226, pero los aislados posteriores mostraron una sustitución de A226V. Esta y otras sustituciones dieron lugar al cuarto linaje, el linaje del Océano Índico.38,39
patogénesis
la patogénesis de la infección por CHIKV en humanos todavía no se conoce bien, pero los brotes recientes han ayudado a proporcionar información sobre las células y los órganos involucrados en la replicación viral., Después de la inoculación intradérmica por mosquitos infectados, el CHIKV entra directamente en los capilares subcutáneos e infecta células susceptibles en la piel: macrófagos, fibroblastos y células endoteliales, donde se produce una replicación limitada.40 los virus producidos localmente son transportados a los órganos linfoides secundarios, donde infecta las células migratorias y libera virus a la circulación linfática y procede a la sangre.20 Una vez en la sangre, el virus tiene acceso a varias partes del cuerpo, incluido el hígado, los músculos, las articulaciones y el cerebro.,41 en estos tejidos, la infección está asociada con una marcada infiltración de células mononucleares. La infiltración de células mononucleares y la replicación viral en músculos y articulaciones se asocian con dolor.
la infección por CHIKV provoca fuertes respuestas sistémicas innatas, que involucran principalmente la producción de IFN-α antiviral, así como muchas citoquinas, quimioquinas y factores de crecimiento proinflamatorios.44 Esto es seguido por la activación de la inmunidad adaptativa a través de la activación y proliferación de células T CD8 + en las primeras etapas de la enfermedad., Un cambio clásico a la respuesta de células T CD4 + y la producción de proteínas antiinflamatorias IL-1ra e IL-2RA son características de etapas posteriores de la fase aguda.44
la infección por CHIKV induce una fuerte respuesta inflamatoria que posiblemente esté orquestada por la producción de IL-16, IL-17, proteína quimioatractante 1 de monocitos (MCP-1), IP-10 y MIP-1α. El final de la fase aguda se caracteriza por la producción de MIF proinflamatoria, MIP-1β, SDF-1α e IL-6 E IL-8. Los niveles de CCL5 (RANTES) también fueron altos en todos los pacientes durante la primera semana después de la aparición de los síntomas.,44 ccl5, MCP-1, IP-10, MIP-1β e IL-8 son producidos por macrófagos activados que son susceptibles a la infección por CHIKV.40 estas quimiocinas desempeñan un papel importante en el reclutamiento de leucocitos a los sitios de infección, coordinando el despliegue de defensas antivirales eficientes.
la infección por CHIKV también induce una fuerte respuesta inmunitaria celular. Los altos niveles plasmáticos de IFN-γ, IL-4, IL-7 e IL-12P40, citocinas que promueven la inmunidad adaptativa, sugirieron la implicación de las respuestas celulares.,También se ha sugerido un papel clave para las células asesinas naturales en la eliminación de células infectadas y en el desarrollo de Artralgia por CHIKV.45 las citocinas promotoras de células B IL-4 y en algunos casos IL-10, también se regularon en los primeros días después del inicio de los síntomas, probablemente iniciando la producción de IgG específica para CHIKV. Además, los linfocitos T CD4+, que también participan en la promoción de las respuestas humorales, se activaron fuertemente hacia el final de la fase aguda.,
los anticuerpos IgG se detectan en la primera semana después de la infección, lo que indica una seroconversión rápida y altos niveles de respuestas de anticuerpos entre los individuos infectados por el CHIKV.46 la IgM específica dura 3-4 meses desde el inicio de la enfermedad, y esa IgG dura más de 6 meses.47 sin embargo, su papel en la artralgia crónica no se comprende muy bien.
manifestaciones clínicas
la fiebre Chikungunya se caracteriza por una enfermedad febril abrupta, poliartralgia y erupción maculopapular. El período de incubación dura 2-4 días (rabia 1-12 días) y las infecciones asintomáticas ocurren en el 5-15% de los casos.,48
Los estudios realizados en pacientes infectados durante el brote de la reunión indicaron que la artralgia era bilateral y simétrica en el 78,4% de los pacientes. Afectó principalmente tobillos, rodillas, manos, muñecas, pies, hombros y codos.49-52 Rash estuvo presente en el 54% de los pacientes, predominantemente en tronco y brazos. Se reportó edema Periarticular en el 45% de los pacientes, afectando los tobillos en mayor proporción. La mialgia y la cefalea estaban presentes en el 72 y el 63% de los pacientes, respectivamente. Los signos hemorrágicos como gingivorragia y epistaxis solo estuvieron presentes en el 10,6% de los pacientes.,
los hallazgos radiológicos son normales y los marcadores biológicos de inflamación como la velocidad de sedimentación eritrocitaria y la proteína C reactiva están moderadamente elevados.49,50,52-54 La iridociclitis y la retinitis son las manifestaciones oculares más comunes asociadas a la infección por CHIKV y tienen un curso benigno con resolución completa y preservación de la visión.55
los signos y síntomas agudos generalmente se resuelven en menos de 2 semanas, pero la artralgia puede durar semanas, meses o incluso años;56,57 este es un síntoma clínico que puede distinguir el CHIKV de la infección por el virus del dengue., También en un análisis univariado, los pacientes infectados por CHIKV mostraron menos síntomas gastrointestinales En comparación con los pacientes infectados por dengue, y una mayor proporción de mialgia y artralgia.
el Chikungunya generalmente no se considera potencialmente mortal; sin embargo, también pueden estar presentes formas graves. Los pacientes con fiebre chikungunya grave que requieren hospitalización tienden a ser mayores y tienen comorbilidades como trastornos cardiovasculares, neurológicos y respiratorios o diabetes, que son factores de riesgo independientes de enfermedad grave.,49,59 Chikungunya grave puede manifestarse como encefalopatía y encefalitis, miocarditis, hepatitis y fallo multiorgánico. Estas formas raras pueden ser fatales y típicamente surgen en pacientes con condiciones médicas subyacentes.60,61 neonatos también están en riesgo de infección grave asociada con signos neurológicos. La tasa de infección de los neonatos nacidos de madres virémicas y expuestos al virus durante el parto puede alcanzar el 50%, lo que conduce a una enfermedad grave y encefalopatía, lo que resulta en secuelas neurológicas a largo plazo y un mal resultado.62
en general, la infección por CHIKV tiene un buen pronóstico., Sin embargo, los pacientes de edad avanzada (63 un estudio mostró que los sujetos que experimentaron afectación reumática inicial grave (seis o más sitios dolorosos con al menos otros cuatro síntomas) en la fase aguda de la infección tenían más probabilidades de presentar dolor musculoesquelético reumático crónico en el seguimiento.63 además, se ha observado simultáneamente una asociación positiva entre títulos altos de IgG específica para CHIKV en la fase plateau y artralgia de larga duración en un estudio piloto y en la cohorte italiana.,63,64 una posible hipótesis mecanicista puede ser que un desequilibrio hacia la expansión y diferenciación de células B, en respuesta a la secreción de IL-6 después de la progresión de la inmunosenescencia65 y chikungunya se desencadene por la persistencia viral en santuarios de huéspedes.66,67
Teniendo en cuenta las características clínicas mencionadas anteriormente, el algoritmo presentado en la Fig. 2 guiaría al clínico a lo largo de la definición del caso y el manejo. Este algoritmo es una adaptación de Palacios-Martínez.68
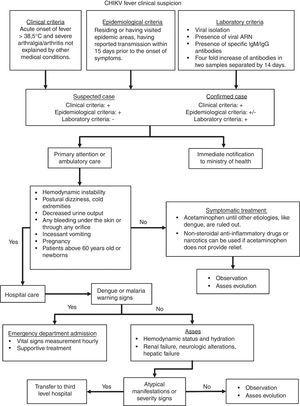
algoritmo diagnóstico y terapéutico de infección por CHIKV.
Diagnóstico
el Chikungunya infección se diagnostica sobre la base de estudios clínicos, epidemiológicos y de laboratorio criterios. Un inicio agudo de fiebre y artralgia severa o artritis que no se explica por otros trastornos médicos se considera un posible caso de CHIKV.,20tres tipos principales de pruebas de laboratorio se utilizan para diagnosticar la infección por CHIKV: aislamiento del virus, reacción en cadena de la polimerasa-transcriptasa inversa (RT-PCR) y serología.
el aislamiento del Virus se puede realizar en mosquitos recolectados en campo o muestras de suero agudo (≤8 días). El suero obtenido de sangre total recolectada durante la primera semana de la enfermedad puede inocularse en una línea celular susceptible o en un ratón lactante en un laboratorio de referencia. Esto puede lograrse si la muestra se transporta fría (entre 2 ° C y 8°C o hielo seco) y lo antes posible (dentro de las 48 horas).,
se han publicado varios ensayos RT-PCR para la detección de ARN CHIKV. Se deben utilizar ensayos de sistema cerrado en tiempo Real, debido a su mayor sensibilidad y menor riesgo de contaminación. Teniendo en cuenta la sensibilidad, la OPS recomienda el uso de los protocolos CHIKV RT-PCR de los Centros para el Control y la prevención de enfermedades y del Instituto Pasteur.14,70 el suero de la sangre entera se utiliza para la prueba de la PCR así como el aislamiento del virus.
para el diagnóstico serológico, el suero obtenido de sangre total se utiliza en el ensayo de inmunoabsorción ligado a enzimas (ELISA)., La muestra de suero (o sangre) debe transportarse a 2-8°C y no debe congelarse. El diagnóstico serológico se puede hacer mediante la demostración de anticuerpos IgM específicos para CHIKV o por un aumento de cuatro veces en el título de IgG en muestras agudas y convalecientes.69
la determinación de IgM puede hacerse mediante diferentes técnicas disponibles comercialmente. Sin embargo, debe tenerse en cuenta que la mejor sensibilidad proviene de las técnicas que utilizan el virus completo como antígeno en comparación con las que utilizan proteínas recombinantes., Dado que los primeros kits disponibles comercialmente tuvieron malos resultados, se recomienda que las técnicas internas para IgM/IgG ELISA se implementen utilizando el antígeno viral purificado y siguiendo los protocolos de los CDC.60 los ensayos ELISA recientes han mejorado la sensibilidad y la especificidad como se muestra en la tabla 1.71 no se recomienda el uso de pruebas rápidas. La segunda muestra para la determinación serológica debe tomarse entre 1 y 2 semanas después de la primera muestra. La seroconversión también se puede detectar como un aumento de IgG por un factor de 4 o más entre las muestras de suero en fase aguda y en fase convaleciente.,69
Accuracies and sensitivities of different chikungunya fever diagnostic assays.
| Assay | Sensibility (%) | Specificity (%) | PPV (%) | NPV (%) |
|---|---|---|---|---|
| RT-PCR | 88.5 | 100 | 100 | 97.,5 |
| Standard Diagnostics Chikungunya IgM ELISA | 3.9 | 92.5 | 10 | 81.6 |
| Novatech Chikungunya IgM Capture ELISA | 76.9 | 91.9 | 100 | 97.5 |
| Novatech Chikungunya IgG Capture ELISA | 80 | 100 | 100 | 95.,6 |
PPV, positive predictive value; NPV, negative predictive value; RT-PCR, reverse transcriptase-polymerase reaction; IgM, immunoglobulin M; IgG, Immunoglobulin G; ELISA, enzyme-linked immunosorbent assay.
Treatment
There is no specific antiviral drug treatment for CHIKV infection., Se recomienda el tratamiento sintomático después de excluir afecciones más graves como la malaria, el dengue y las infecciones bacterianas.20,21
en la infección aguda, el tratamiento es sintomático y de apoyo, compuesto por descanso y el uso de paracetamol para aliviar la fiebre (
g/día). El uso de ibuprofeno, naproxeno u otro agente antiinflamatorio no esteroideo (AINE) para aliviar el componente Artrítico de la enfermedad se puede usar cuando se descarta la infección por dengue.60 en pacientes con dolores articulares severos que no se alivian con AINE, tramadol o narcóticos (por ejemplo, morfina) pueden ser aconsejados.,60,61 se debe aconsejar a los pacientes que beban abundante líquido para reponer el líquido perdido por sudoración, vómitos y otras pérdidas insensibles.60,72
mientras que la recuperación de CHIK es el resultado esperado, la convalecencia puede ser prolongada y el dolor articular persistente puede requerir manejo del dolor, incluyendo terapia antiinflamatoria a largo plazo. El tratamiento específico para la poliartralgia difusa post-CHIKV en estadio crónico consiste en AINEs orales o tópicos más un curso corto de corticoterapia oral o inyección de corticoides en la articulación afectada., El dolor neuropático puede tratarse con antidepresivos tricíclicos, medicamentos antiepilépticos o tramadol.
aunque un estudio anterior sugirió que el fosfato de hidroxicloroquina ofrecía algún beneficio en la artralgia, 74 estudios posteriores no confirmaron su eficacia.73,75,76
en pacientes con síntomas articulares refractarios, se pueden evaluar terapias alternativas como el metotrexato (MTX). En un estudio retrospectivo realizado en la isla de la reunión, 54 de 72 pacientes tuvieron una respuesta clínica positiva cuando fueron tratados con MTX.,Cuando el MTX está contraindicado o es ineficaz, se pueden utilizar agentes biológicos inmunomoduladores como etanercept, rituximab o tocilizumab.73
se ha demostrado que los pacientes con artritis reumatoide tienen bajos niveles de vitamina D y una correlación negativa con la actividad de la enfermedad.78 por lo tanto, la reposición de la vitamina D podría mejorar la gravedad de la enfermedad. En un estudio realizado en la India, los pacientes con artritis crónica relacionada con el CHIKV fueron tratados con vitamina D y calcio durante cinco meses, lo que mejoró el dolor articular y la fatiga.,79
Además de la farmacoterapia, los casos con artralgia y rigidez articular pueden beneficiarse de un programa de fisioterapia graduada en etapas agudas y crónicas de la enfermedad. El movimiento y el ejercicio leve tienden a mejorar la rigidez y el dolor matutinos, pero el ejercicio intenso puede exacerbar los síntomas.
prevención
a la espera del desarrollo de la vacuna, las únicas medidas preventivas eficaces consisten en la protección individual contra las picaduras de mosquitos y el control de vectores., El Control de las poblaciones de mosquitos adultos y larvarios utiliza el mismo modelo que para el dengue y ha sido relativamente eficaz en muchos países y entornos.80 el control de mosquitos es el mejor método disponible para prevenir la infección por CHIKV. Los criaderos deben ser removidos, destruidos, vaciados frecuentemente y limpiados o tratados con insecticidas.3
para la protección, se recomienda ropa que minimice la exposición de la piel a los vectores que muerden el día. Los repelentes se pueden aplicar a la piel expuesta o a la ropa en estricta conformidad con las instrucciones de la etiqueta del producto., Los repelentes deben contener DEET (N,N-dietil-3-metilbenzamida), IR3535 (éster etílico del ácido 3-aminopropiónico) o icaridina(ácido 1-piperidinocarboxílico, 2-(2-hidroxietil)-1-metilpropilester). Las bobinas para mosquitos u otros vaporizadores insecticidas también pueden reducir las picaduras en interiores.3
vacunas
actualmente no existe una vacuna comercial para el CHIKV, aunque algunas vacunas candidatas han sido probadas en seres humanos.,81,82
Se han utilizado varias tecnologías para desarrollar vacunas CHIK, incluidas vacunas virales inactivadas, virus vivos atenuados, quimeras de alfavirus, vacunas virales recombinantes, vacunas de ADN basadas en consenso, vacunas de subunidades recombinantes y, más recientemente, una vacuna de partículas similares a virus (VLP).
dos candidatos a vacunas han finalizado los ensayos de fase I: una vacuna de Chikungunya recombinante viva basada en el virus del sarampión y la vacuna VRC-CHKVLP059-00-VP, VLP., La vacuna de Chikungunya basada en virus recombinantes vivos contra el sarampión tenía buena inmunogenicidad, incluso en presencia de inmunidad al sarampión, era segura y tenía un perfil de tolerabilidad generalmente aceptable.La vacuna VLP, VRC-CHKVLP059-00-VP también fue inmunogénica, segura y bien tolerada.84
carga económica
en la India, la epidemia de chikungunya en 2006 impuso una pesada carga epidemiológica y una pérdida de productividad a la comunidad. La carga nacional de chikungunya se estimó en 25.588 AVAD perdidos durante la epidemia de 2006., Se encontró que la artralgia persistente imponía una carga pesada, representando el 69% del total de AVAD. La pérdida de productividad en términos de pérdida de ingresos se estimó en un mínimo de 6 millones de dólares.Otros 85 estudios realizados en la India informaron que la carga para Andhra Pradesh era de 6.600 AVAD (costo: 12.400.000 dólares de los EE.UU.). Si bien la carga era moderada, los costos eran altos y en su mayoría de bolsillo.86
un estudio realizado con policías militares en la reunión en junio de 2006 informó que la mayoría de los pacientes sintomáticos (93.,7%) se quejó de una etapa crónica de la enfermedad, que se caracteriza por dolores en articulaciones o huesos, o ambos, aunque la investigación se realizó 6 meses después del pico epidémico. La mayoría de los adultos que trabajan son discapacitados con pérdida de movilidad, discapacidad de las manos y reacción depresiva, que puede durar de semanas a meses y tiene consecuencias negativas en la salud, la organización social y la economía en áreas epidémicas.87,88
con estos antecedentes, si el brote se extiende por todo México, los adultos trabajadores infectados quedarán incapacitados y aumentarán la carga económica.,
conclusión
la llegada del CHIKV a América será un desafío para el sistema de salud pública y una carga económica significativa. La probabilidad de transmisión autóctona en el resto de México y Estados Unidos es alta debido a la ubicuidad del vector. El desarrollo económico no protege a los países de las enfermedades transmitidas por vectores; los estilos de vida modernos pueden amplificar una epidemia a través de los viajes, el envejecimiento de la población y la producción de desechos sólidos que pueden albergar a los mosquitos Aedes.
financiación
no se prestó apoyo financiero.
conflicto de intereses
los autores no tienen conflictos de intereses que declarar.