Massa atomica
Le masse dei singoli atomi sono molto, molto piccole. Utilizzando un dispositivo moderno chiamato spettrometro di massa, è possibile misurare masse così minuscole. Un atomo di ossigeno-16, ad esempio, ha una massa di \(2,66 \volte 10^{-23} \: \text{g}\). Mentre i confronti delle masse misurate in grammi avrebbero una certa utilità, è molto più pratico avere un sistema che ci permetterà di confrontare più facilmente le masse atomiche relative., Gli scienziati hanno deciso di utilizzare il nuclide di carbonio-12 come standard di riferimento con cui tutte le altre masse sarebbero state confrontate. Per definizione, a un atomo di carbonio-12 viene assegnata una massa di 12 unità di massa atomica \(\left (\text{amu}\right)\). Un’unità di massa atomica è definita come una massa pari a un dodicesimo della massa di un atomo di carbonio-12. La massa di qualsiasi isotopo di qualsiasi elemento è espressa in relazione allo standard carbonio-12. Ad esempio, un atomo di elio-4 ha una massa di \(4.0026 \: \text{amu}\). Un atomo di zolfo-32 ha una massa di \(31.972\: \ text{amu}\).,
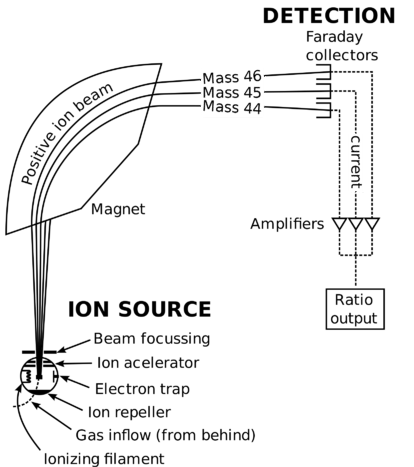
Schema dello spettrometro di massa.
L’atomo di carbonio-12 ha sei protoni e sei neutroni nel suo nucleo per un numero di massa di 12. Poiché il nucleo rappresenta quasi tutta la massa dell’atomo, un singolo protone o un singolo neutrone ha una massa di circa \(1 \: \text{amu}\). Tuttavia, come si vede dagli esempi di elio e zolfo, le masse dei singoli atomi non sono numeri interi., Questo perché la massa di un atomo è influenzata leggermente dalle interazioni delle varie particelle all’interno del nucleo, e la piccola massa dell’elettrone viene presa in considerazione.