As enzimas são moléculas orgânicas específicas encontradas em sistemas biológicos que permitem que a vida celular exista e funcione às temperaturas da terra. A maioria das reacções químicas que suportam a vida só podem ocorrer acima de 90°C ou 200°F na ausência de enzimas. Enzimas são referidas como catalisadores biológicos macromoleculares. Eles permitem a existência de reações que não ocorreriam de outra forma sob numerosas condições que têm a ver com temperatura, pH e condições atmosféricas dentro do corpo humano., Processos metabólicos dentro das células requerem catalisadores enzimáticos, a fim de ocorrer a taxas suficientemente rápidas para suportar a vida. Enzimas são conhecidas por catalisar mais de 5.000 tipos de reação bioquímica. O estudo deste tema complexo é chamado de enzimologia. enzimas aceleram a taxa de reação química de várias maneiras, reduzindo a energia de ativação. Energia de ativação é a energia que deve estar disponível para um sistema químico ou nuclear com reagentes potenciais para produzir uma reação ou produto. As enzimas reagem com outras substâncias, quer para as desmontar, quer para as juntar., Eles não alteram a posição do equilíbrio químico da reação. durante a presença de uma enzima, a reação se move na mesma direção que faria sem a enzima, no entanto a presença de enzimas acelera o processo.
enzimas aceleram a taxa de reação química de várias maneiras, reduzindo a energia de ativação. Energia de ativação é a energia que deve estar disponível para um sistema químico ou nuclear com reagentes potenciais para produzir uma reação ou produto. As enzimas reagem com outras substâncias, quer para as desmontar, quer para as juntar., Eles não alteram a posição do equilíbrio químico da reação. durante a presença de uma enzima, a reação se move na mesma direção que faria sem a enzima, no entanto a presença de enzimas acelera o processo.
função e natureza das enzimas
As enzimas são responsáveis por:
1. Transdução de sinal e regulação celular muitas vezes por cinases e fosfatases.
2. Gerando movimento com miosina (proteína muscular) hidrolisando ATP para gerar contração muscular.
3. Transportando carga em torno da célula como parte do citoesqueleto.
4., Digestão, metabolismo, respiração
5. Enzimas digestivas como as amilases e a protease decompõem grandes moléculas de amidos ou proteínas em pequenas para absorção adequada nos intestinos.
6. Produção de hormonas.
7. Absorção de nutrientes e transporte.
8. Reparação celular e divisão.
9. Desintoxicação
10. Doença: os vírus podem conter enzimas para infectar as células, ou seja, a integrase do VIH e a transcriptase reversa.
enzimas
1. Estabilize o estado de transição: A., Criar um ambiente com uma distribuição de carga complementar à do Estado de transição para reduzir a sua energia.
2. Fornecer uma via de reação alternativa: A. reage temporariamente com o substrato, formando um intermediário covalente para fornecer um estado de transição de energia mais baixo.
3. Destabiliza o estado do solo do substrato: A. distorce subtrair encadernado (s) em sua forma de Estado de transição para reduzir a energia necessária para alcançar o estado de transição. B. Orientar os substratos em um arranjo produtivo para reduzir a mudança de entropia de reação (termodinâmica).,as enzimas reagem essencialmente com outras substâncias, quer para as desmontar, quer para as unir.
As enzimas são divididas como:
1. Simples: contém apenas a parte proteica (por exemplo, hidrolases como pepsina, tripsina ou ribonuclease).
2. Complexo: as proteínas podem ser unidas com uma parte não-proteica, referida como grupos protéticos. A parte proteica é chamada de apoenzima. A parte não proteica é referida como Cofactor. Em conjunto, a apoenzima e o Cofactor formam uma molécula biologicamente activa da enzima – a holoenzima.
cofactores:
A., Ião metálico: ajuda a enzima a posicionar a molécula do substrato no local activo. Chamados ativadores, os metais associados podem incluir cobre, cobalto, zinco, magnésio, molibdênio e manganês.coenzimas: uma molécula orgânica não-proteica que se liga à molécula de apoenzima livremente, assim pode se separar dela, ou seja, NAD+ (nicotinamida adenina dinucleótido) e NADP+ (nicotinamida adenina dinucleótido fosfato). NAD+ e NADP+ são portadores de elétrons na respiração celular., NADP+ é criado em reação anabólica, ou reação que constrói grandes moléculas de pequenas moléculas.
D. grupo prostético: uma molécula orgânica não proteica que se liga firmemente à molécula de apoenzima, ou seja, heme, FAD (flavina adenina dinucleótido)
um substrato
As moléculas sobre as quais as enzimas reagem são chamadas de substrato. A enzima permanece intacta e não é consumida durante reacções químicas. Nem alteram a estabilidade de uma reacção. Em vez disso, eles apoiam a progressão de uma reação mantendo o equilíbrio., A maioria das enzimas são proteínas compostas de aminoácidos, os blocos básicos de construção dentro do corpo. existem exceções com alguns tipos de moléculas de RNA chamadas ribozimas. As moléculas de aminoácidos são conectadas através de ligações conhecidas como ligações peptídicas que formam proteínas.as enzimas são compostas por um número diferente de cadeias peptídicas e são denominadas complexos de multienzima. Um exemplo de complexos de multienzima seria a sintetase de ácidos graxos, uma enzima catalisando a síntese de ácidos graxos mais elevados nas células., Quimicamente, os pequenos grupos de aminoácidos ligados são chamados moléculas poliméricas ou referidos na bioquímica como poli peptídeos. são precisos 30 aminoácidos para formar uma cadeia suficientemente longa que permita às moléculas influenciar a sua própria forma, tornando-se uma proteína. Seja uma cadeia ou várias cadeias, ela contém várias partes chamadas domínios. As proteínas servem inúmeras funções bioquímicas, incluindo características estruturais anatômicas em organismos, Portadores de nutrientes, antigénios e hormônios.,
O complexo de substrato enzimático
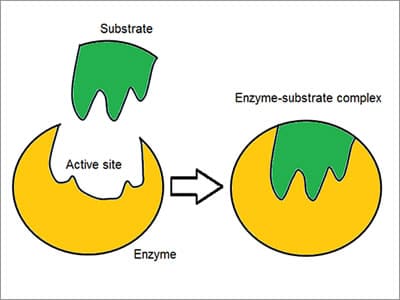 Coined as a” Lock and key ” model, enzymes react with other substances to either take them apart or join them together. Existe uma elevada especificidade das enzimas demonstrada pela forma como se associam ou se ligam ao substrato: a molécula reagente. Quimiosselectiva, cada molécula enzimática tem um local activo na sua superfície. A molécula reagente é atraída e moldada na indentação que forma o local ativo., a especificidade é alcançada através de bolsas de ligação com características complementares, de forma, de carga e hidrofílicas/hidrofóbicas para os substratos. O local ativo continua a mudar até que o substrato esteja completamente ligado, resultando em uma forma final. dito isto, as enzimas são estruturas flexíveis e o local activo é continuamente remodelado pela interacção com o substrato à medida que interage com a enzima.as enzimas guiam e regulam o metabolismo de uma célula e são cuidadosamente controladas., O mecanismo de ação das enzimas envolve moléculas regulatórias que podem aumentar (ativador) ou inibir (inibidores) a atividade de uma enzima. Um inibidor enzimático é uma molécula que se liga a uma enzima e bloqueia a ligação de um substrato, diminuindo a sua actividade. Se uma enzima produz demasiada substância num organismo, essa substância começa a actuar como um inibidor para a enzima no início da Via como uma forma de feedback negativo, atrasando a reacção. As drogas podem ser inibidores enzimáticos., Por exemplo, bloquear a actividade de uma enzima pode matar um agente patogénico ou corrigir um desequilíbrio metabólico.o controlo da actividade enzimática é essencial para a homeostase no organismo. Quando há um mau funcionamento de uma enzima como uma mutação, sobre ou sob produção, ou exclusão, isso pode levar a uma doença genética. Em alguns casos, pode ser fatal. Por exemplo, insuficiência pancreática é uma condição que ocorre quando o pâncreas não faz o suficiente de uma enzima específica necessária para digerir alimentos no intestino delgado.,
Coined as a” Lock and key ” model, enzymes react with other substances to either take them apart or join them together. Existe uma elevada especificidade das enzimas demonstrada pela forma como se associam ou se ligam ao substrato: a molécula reagente. Quimiosselectiva, cada molécula enzimática tem um local activo na sua superfície. A molécula reagente é atraída e moldada na indentação que forma o local ativo., a especificidade é alcançada através de bolsas de ligação com características complementares, de forma, de carga e hidrofílicas/hidrofóbicas para os substratos. O local ativo continua a mudar até que o substrato esteja completamente ligado, resultando em uma forma final. dito isto, as enzimas são estruturas flexíveis e o local activo é continuamente remodelado pela interacção com o substrato à medida que interage com a enzima.as enzimas guiam e regulam o metabolismo de uma célula e são cuidadosamente controladas., O mecanismo de ação das enzimas envolve moléculas regulatórias que podem aumentar (ativador) ou inibir (inibidores) a atividade de uma enzima. Um inibidor enzimático é uma molécula que se liga a uma enzima e bloqueia a ligação de um substrato, diminuindo a sua actividade. Se uma enzima produz demasiada substância num organismo, essa substância começa a actuar como um inibidor para a enzima no início da Via como uma forma de feedback negativo, atrasando a reacção. As drogas podem ser inibidores enzimáticos., Por exemplo, bloquear a actividade de uma enzima pode matar um agente patogénico ou corrigir um desequilíbrio metabólico.o controlo da actividade enzimática é essencial para a homeostase no organismo. Quando há um mau funcionamento de uma enzima como uma mutação, sobre ou sob produção, ou exclusão, isso pode levar a uma doença genética. Em alguns casos, pode ser fatal. Por exemplo, insuficiência pancreática é uma condição que ocorre quando o pâncreas não faz o suficiente de uma enzima específica necessária para digerir alimentos no intestino delgado.,
Table 1-Factors affecting or control enzyme activity 
Temperature modulation
The catalytic activity of enzymes requires optimum temperature within the body. As enzimas humanas têm actividade máxima a 37oC. As enzimas podem tornar-se vulneráveis a alterações de temperatura. Devido à sua natureza proteica, a aplicação de alta temperatura entre 55-60o C provoca a desnaturação de proteínas, produzindo uma mudança conformacional e destruição de proteínas. Esta mudança causa uma queda ou uma parada completa da reação., Além disso, as baixas temperaturas podem retardar reações, reduzindo a atividade das enzimas.as enzimas são sensíveis à mudança de pH. como em mudanças de temperatura, extremos de baixa e alta novamente levam à desnaturação das moléculas. A concentração de H+ afeta a ionização dos grupos ácido e base
fontes enzimáticas
1. Enzimas metabólicas: regula órgãos, tecidos e sangue. Ajude a criar novas células, reparar as células danificadas existentes e move nutrientes para onde o seu corpo mais precisa deles.
2. Enzimas digestivas: decompõe a comida. Subtipos-amilase, lipase, protease
3., Alimentos crus: suporta o sistema imunológico, reparação celular.existem seis classes principais de enzimas com função específica. Existem também subgrupos.
Table 2 – Enzyme types
Enzyme subgroups:
Hydrolases are enzymes that split out water, separating the parts of molecules.Hidrogenases são enzimas que adicionam átomos de hidrogênio a outras moléculas; 5 alfa redutase é um exemplo.Oxidases catalisam oxidações adicionando oxigênio ou elétrons a moléculas ou átomos.,
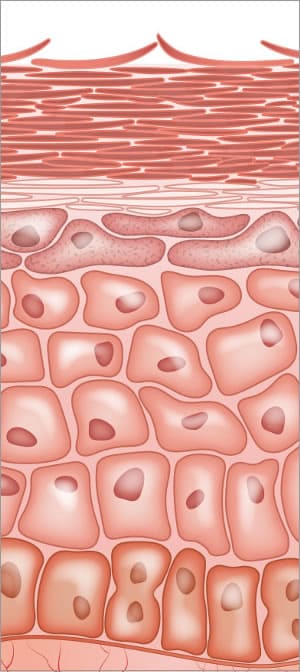 enzimas na pele; construção da barreira cutânea e o processo final de descamação
enzimas na pele; construção da barreira cutânea e o processo final de descamação
todo o processo de diferenciação epidérmica é dependente da actividade enzimática. As hidrolases lipídicas são responsáveis pela conversão de lípidos em ceramidas e ácidos gordos livres. As enzimas estão envolvidas na modificação da profilaggrina e no processamento proteolítico na epiderme. As fases de transição saudáveis de todo o processo de construção do estrato córneo são vitais e dependem das enzimas.,as enzimas da Protease são essenciais para o processo normal de descamação dentro das células do stratum corneum (SC). Os desmossomas são importantes para uma forte adesão célula-a-célula. O processo de descamação envolve a proteólise de estruturas adesivas intercelulares criadas nas estruturas desmossomas. Existem enzimas protease específicas no estrato córneo chamadas enzima triptica e enzima quimotriptica envolvidas com a degradação dos corneodesmosomas. Duas proteínas encontradas nos desmossomas são desmogleína e desmocollin, localizadas nas interconexões dentro das células., a enzima timotriptica do estrato córneo é produzida como um precursor inactivo sem actividade proteolítica. Assim, existe uma exigência de uma enzima activadora que envolve uma enzima com substrato semelhante a tripsina. Diferentes proteases atacam os diferentes locais de aminoácidos nas proteínas desmogleína e desmocollin. Quando as ligações são enfraquecidas, quebram-se, permitindo que as células desabem. o processo de descamação requer água dentro da epiderme e um pH normal. a orquestração de todas as atividades biológicas é complexa e deve trabalhar sinergisticamente uns com os outros.
1., Pugliese, Peter T. MD. (2005) Appendix A. Enzymes and Enzyme Activity. Advanced Professional Skin Care-Medical Edition. p 390-392 the Topical Agent, LLC, Burnsville, PA
2. Enzima. Wikipedia.org Retrieved from https://en.wikipedia.org/wiki/Enzyme
3. Ibidem-Pugliese-Ref 1
4. IBID-Lavrikova p.
5. Autor: Petra Lavrikova. Capítulo 6. Enzima. Função das células e do corpo humano. Retrieved from http://fblt.cz/en/skripta/ii-premena-latek-a-energie-v-bunce/6-enzymy/
6. IBID-Lavrikova p.
7. IBID-Pugliese
8. Ibidem-ver ref. 2
9. Regulação Enzimática., Biology Energy and Enzymes Retrieved from https://www.khanacademy.org/science/biology/energy-and-enzymes/enzyme-regulation/a/enzyme-regulation
10. Inibidor enzimático obtido de https://en.wikipedia.org/wiki/Enzyme_inibitor
11. Insuficiência Pancreática. Centro de Doenças Digestivas, Universidade Médica da Carolina do Sul. Retrieved from http://ddc.musc.edu/public/diseases/pancreas-biliary-system/pancreatic-insufficiency.html
12. Regulação Enzimática. Biologia, energia e enzimas. Khan Academy p. 2 Retrieved from
13. IBID-Lavrikova, pg. 5
14. Snyder, Kimberly. (December 06 2017) How Enzymes Affect Beauty and Health. Retrieved from https://www.huffingtonpost.com/kimberly-snyder/enzymes-beauty-health_b_1201847.html
15. IBID-Pugliese pg 391
16., IBID-Lavrikova p 7
17. Preland, R., Rothnagel, J., Lawrence, O. (2006) Chapter 9, Profilaggrin and the Fused S100 Family of Calcium-Binding Proteins. Barreira cutânea, Elias& Feingold.
18. Ekholm, E., Brattasnd, M., Egelrud, T. (Jan. 2000) Stratum Corneum Tryptic Enzyme in Normal epiderme: A Missing Link in the Descamation Process? Journal of Investigative Dermatology, Vol 114, Issue 1, PP 56-63 Retrieved from https://www.sciencedirect.com/science/article/pii/S0022202X15407316
19. Ibidem-Pugliese-Ref 1
20. Ibidem-Ref 17, p. 56