masa atomică
masele atomilor individuali sunt foarte, foarte mici. Folosind un dispozitiv modern numit spectrometru de masă, este posibil să se măsoare astfel de mase minuscule. Un atom de oxigen-16, de exemplu, are o masă de \(2,66 \ ori 10^{-23} \: \ text{g}\). În timp ce comparațiile maselor măsurate în grame ar avea o anumită utilitate, este mult mai practic să avem un sistem care să ne permită să comparăm mai ușor masele atomice relative., Oamenii de știință au decis să utilizeze nuclidul carbon-12 ca standard de referință prin care toate celelalte mase ar fi comparate. Prin definiție, unui atom de carbon-12 i se atribuie o masă de 12 unități de masă atomică \(\left( \text{amu} \right)\). O unitate de masă atomică este definită ca o masă egală cu A douăsprezecea masa unui atom de carbon-12. Masa oricărui izotop al oricărui element este exprimată în raport cu standardul carbon-12. De exemplu, un atom de heliu-4 are o masă de \(4.0026\: \ text{amu}\). Un atom de sulf-32 are o masă de \(31.972 \: \text{amu}\).,
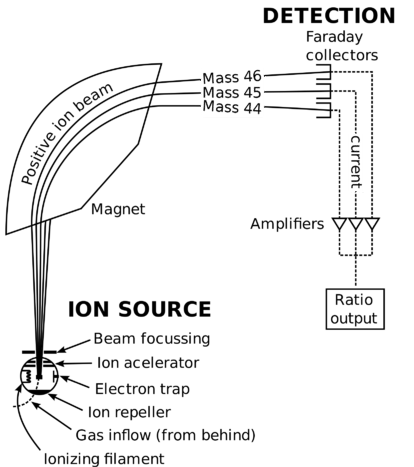
Spectrometru de masă schematică.atomul de carbon-12 are șase protoni și șase neutroni în nucleul său pentru un număr de masă de 12. Deoarece nucleul reprezintă aproape toată masa atomului, un singur proton sau un singur neutron are o masă de aproximativ \(1 \: \text{amu}\). Cu toate acestea, așa cum se vede în exemplele de heliu și sulf, masele atomilor individuali nu sunt numere întregi., Acest lucru se datorează faptului că masa unui atom este afectată foarte ușor de interacțiunile diferitelor particule din nucleu, iar masa mică a electronului este luată în considerare.