enzimele sunt molecule organice specifice găsite în sistemele biologice care permit vieții celulare să existe și să funcționeze la temperaturile pământului. Majoritatea reacțiilor chimice care susțin viața pot apărea numai peste 90°C sau 200°F în absența enzimelor. Enzimele sunt denumite catalizatori biologici macromoleculari. Acestea permit existența unor reacții care nu ar avea loc altfel în numeroase condiții care au legătură cu temperatura, pH-ul și condițiile atmosferice din corpul uman., Procesele metabolice din celule necesită catalizatori enzimatici pentru a avea loc la rate suficient de rapide pentru a susține viața. Enzimele sunt cunoscute pentru a cataliza mai mult de 5.000 de tipuri de reacții biochimice. Studiul acestui subiect complex se numește enzimologie. enzimele accelerează rata de reacție chimică în numeroase moduri, scăzând energia de activare. Energia de activare este energia care trebuie să fie disponibilă unui sistem chimic sau nuclear cu reactanți potențiali pentru a produce o reacție sau un produs. Enzimele reacționează cu alte substanțe, fie pentru a le separa, fie pentru a le uni., Ele nu modifică poziția echilibrului chimic al reacției.
enzimele accelerează rata de reacție chimică în numeroase moduri, scăzând energia de activare. Energia de activare este energia care trebuie să fie disponibilă unui sistem chimic sau nuclear cu reactanți potențiali pentru a produce o reacție sau un produs. Enzimele reacționează cu alte substanțe, fie pentru a le separa, fie pentru a le uni., Ele nu modifică poziția echilibrului chimic al reacției.
în timpul prezenței unei enzime, reacția se mișcă în aceeași direcție ca și fără enzimă, totuși prezența enzimei accelerează procesul.funcția și natura enzimelor enzimele sunt responsabile pentru:
1. Transducția semnalului și reglarea celulelor adesea prin kinaze și fosfataze.
2. Generarea mișcării cu miozina (proteina musculară) hidrolizând ATP pentru a genera contracția musculară.
3. Transportarea încărcăturii în jurul celulei ca parte a citoscheletului.
4., Digestie, metabolism, respirație
5. Enzimele Digestive, cum ar fi amilazele și proteaza, descompun moleculele mari de amidon sau proteine în cele mai mici pentru o absorbție adecvată în intestine.
6. Producția de hormoni.
7. Absorbția și transportul nutrienților.
8. Repararea și divizarea celulară.
9. Detoxifiere
10. Boala: virusurile pot conține enzime pentru infectarea celulelor, adică integraza HIV și reverstranscriptaza.
enzime
1. Stabilizați starea de tranziție: a., Creați un mediu cu o distribuție de încărcare complementară cu cea a stării de tranziție pentru a-și scădea energia.
2. Furnizați o cale alternativă de reacție: a. reacționează temporar cu substratul, formând un intermediar covalent pentru a oferi o stare de tranziție energetică mai mică.
3. Destabilizează starea de bază a substratului: a. distorsionează scăderile legate în forma lor de stare de tranziție pentru a reduce energia necesară pentru a ajunge la starea de tranziție. B. orientați substraturile într-un aranjament productiv pentru a reduce schimbarea entropiei de reacție (termodinamică).,
enzimele reacționează în mod esențial cu alte substanțe, fie pentru a le separa, fie pentru a le uni.
enzimele sunt împărțite ca:
1. Simplu: conține numai partea proteică (de exemplu, hidrolaze precum pepsină, tripsină sau ribonuclează).
2. Complex: proteinele pot fi unite cu o parte non-proteică, denumită grupuri protetice. Partea proteică se numește apoenzimă. Partea non-proteică este denumită Cofactor. Împreună, apoenzima și cofactorul formează o moleculă biologic activă a enzimei-holoenzima.
cofactori:
a., Ionul metalic: ajută enzima să poziționeze molecula substratului în locul activ. Numite activatori, metalele asociate pot include cupru, cobalt, zinc, magneziu, molibden și mangan.
b. Moleculă organică: de multe ori vitamine, cum ar fi riboflavina, vitaminele B și vitamina C.
c. Coenzime: un non-proteine organice cu molecule care se leagă de molecula de apoenzyme liber, astfel poate desprinde de ea, adică NAD+ (Nicotinamid-adenin-dinucleotid) și NADP+ (Nicotinamid-adenin-dinucleotid fosfat). Nad+ și NADP+ sunt purtători de electroni în respirația celulară., NADP+ este creat în reacție anabolic, sau reacție care construi molecule mari din molecule mici.
D. grup protetic: o moleculă organică non-proteică care se leagă strâns de molecula apoenzimei, adică heme, FAD (flavin adenină dinucleotidă)
un substrat
moleculele la care reacționează enzimele se numește substrat. Enzima rămâne intactă și nu este consumată în timpul reacțiilor chimice. Nici nu modifică stabilitatea unei reacții. În schimb, ele susțin progresia unei reacții care menține echilibrul., Majoritatea enzimelor sunt proteine alcătuite din aminoacizi, blocurile de bază din organism.
există excepții cu unele tipuri de molecule de ARN numite ribozime. Moleculele de aminoacizi sunt conectate prin legături cunoscute sub numele de legături peptidice care formează proteine.
enzimele sunt alcătuite dintr-un număr diferit de lanțuri peptidice și sunt denumite complexe multienzimice. Un exemplu de complexe multienzimice ar fi sintaza acidului gras, o enzimă care catalizează sinteza acizilor grași mai mari în celule., Chimic, grupurile mici de aminoacizi legați sunt numite molecule polimerice sau menționate în biochimie ca poli peptide.
este nevoie de 30 de aminoacizi pentru a forma un lanț suficient de lung care să permită moleculelor să-și influențeze propria formă pentru a deveni o proteină. Indiferent dacă un lanț sau mai multe lanțuri, acesta conține mai multe părți numite domenii. Proteinele servesc numeroase funcții biochimice, inclusiv caracteristici structurale anatomice în organisme, purtători de nutrienți, antigeni și hormoni.,
Complexul enzimă – substrat
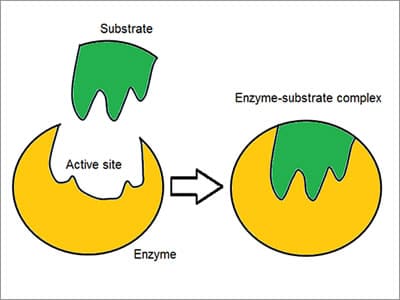 inventat ca model de „blocare și cheie”, enzimele reacționează cu alte substanțe fie pentru a le separa, fie pentru a le uni. Există o specificitate ridicată a enzimelor demonstrată prin modul în care se asociază sau se leagă cu substratul: molecula reactantă. Chemoselective, fiecare moleculă de enzimă are un situs activ pe suprafața sa. Molecula reactantă este atrasă și turnată în indentarea care formează site-ul activ.,
inventat ca model de „blocare și cheie”, enzimele reacționează cu alte substanțe fie pentru a le separa, fie pentru a le uni. Există o specificitate ridicată a enzimelor demonstrată prin modul în care se asociază sau se leagă cu substratul: molecula reactantă. Chemoselective, fiecare moleculă de enzimă are un situs activ pe suprafața sa. Molecula reactantă este atrasă și turnată în indentarea care formează site-ul activ.,
specificitatea se realizează prin legarea buzunarelor cu caracter complementar, de formă, de încărcare și hidrofil / hidrofob caracteristice substraturilor. Locul activ continuă să se schimbe până când substratul este complet legat, rezultând o formă finală. acestea fiind spuse, enzimele sunt structuri flexibile, iar situsul activ este remodelat continuu prin interacțiunea cu substratul, deoarece interacționează cu enzima.
controlul activității enzimatice
enzimele ghidează și reglează metabolismul unei celule și sunt controlate cu atenție., Mecanismul de acțiune al enzimelor implică molecule de reglementare care pot fie să crească (activator), fie să inhibe (inhibitori) activitatea unei enzime. Un inhibitor al enzimei este o moleculă care se leagă de o enzimă și blochează legarea unui substrat, scăzând activitatea acestuia. Dacă o enzimă produce prea mult dintr-o substanță într-un organism, acea substanță începe să acționeze ca inhibitor al enzimei la începutul căii ca o formă de feedback negativ, încetinind reacția. Medicamentele pot fi inhibitori ai enzimelor., De exemplu, blocarea activității unei enzime poate ucide un agent patogen sau poate corecta un dezechilibru metabolic.controlul activității enzimatice este esențial pentru homeostazia în organism. Atunci când există o funcționare defectuoasă a unei enzime, cum ar fi o mutație, o producție excesivă sau insuficientă sau o deleție, aceasta poate duce la o boală genetică. În unele cazuri, poate fi fatală. De exemplu, insuficiența pancreatică este o afecțiune care apare atunci când pancreasul nu face suficient de o enzimă specifică necesară pentru digerarea alimentelor în intestinul subțire.,Tabelul 1-factorii care afectează sau controlează activitatea enzimelor

modularea temperaturii
activitatea catalitică a enzimelor necesită o temperatură optimă în organism. Enzimele umane au activitate maximă la 37oC. Enzimele pot deveni vulnerabile la schimbările de temperatură. Datorită naturii lor proteice, aplicarea temperaturii ridicate între 55-60o c determină denaturarea proteinei, producând o schimbare conformațională și distrugerea proteinei. Această modificare determină o scădere sau o oprire completă a reacției., Mai mult, temperaturile scăzute pot încetini reacțiile, reducând activitatea enzimelor.enzimele pH sunt sensibile la modificarea pH-ului. ca și în cazul schimbărilor de temperatură, extremele joase și înalte conduc din nou la denaturarea moleculelor. Concentrația de H + afectează ionizarea grupărilor acide și bazice
surse enzimatice
1. Enzime metabolice: reglează organele, țesuturile și sângele. Ajuta la crearea de noi celule, repararea celulelor deteriorate existente și se mută substanțe nutritive în cazul în care organismul cel mai are nevoie de ele.
2. Enzime Digestive: descompune alimentele. Subtipuri-amilază, lipază, protează
3., Alimente crude: susține sistemul imunitar, repararea celulară.
există șase clase majore de enzime cu funcție specifică. Există, de asemenea, subgrupuri.
Tabelul 2 – tipuri de enzime
subgrupuri enzimatice:
Hidrolazele sunt enzime care împart apa, separând părțile moleculelor.
Hidrogenazele sunt enzime care adaugă atomi de hidrogen la alte molecule; 5 alfa reductază este un exemplu.
Oxidazele catalizează oxidările prin adăugarea de oxigen sau electroni la molecule sau atomi.,
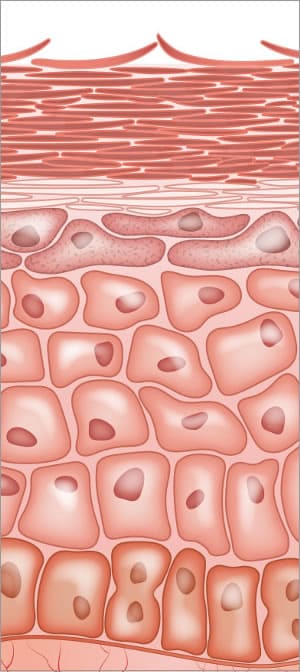 enzimele din piele; construirea barierei cutanate și procesul final de descuamare
enzimele din piele; construirea barierei cutanate și procesul final de descuamare
întregul proces de diferențiere epidermică depinde de activitatea enzimatică. Hidrolazele lipidice sunt responsabile pentru Conversia lipidelor în ceramide și acizi grași liberi. Enzimele sunt implicate în modificarea profilaggrinului și prelucrarea proteolitică în epidermă. Fazele de tranziție sănătoase ale întregului proces de construcție a stratului cornos sunt vitale și depind de enzime.,
enzimele de protează sunt esențiale pentru procesul normal de descuamare din celulele stratului cornos (SC). Desmosomii sunt importanți pentru adeziunea puternică celulă-celulă. Procesul de descuamare implică proteoliza structurilor adezive intercelulare create în structurile desmosome. Există anumite enzime proteaze în stratul cornos numit tryptic enzimă și chymotryptic enzimă implicată cu degradarea corneodesmosomes. Două proteine găsite în desmosomi sunt desmoglein și desmocollin, situate la interconexiunile din interiorul celulelor.,
enzima chimotriptică a stratului cornos este produsă ca un precursor inactiv, fără activitate proteolitică. Prin urmare, există o cerință a unei enzime de activare care implică o enzimă cu substrat asemănător tripsinei. Proteazele diferite atacă diferitele situsuri de aminoacizi pe proteinele desmoglein și desmocollin. Când legăturile sunt slăbite, ele se rup, permițând celulelor să se desprindă. procesul de descuamare necesită apă din interiorul epidermei și un pH normal. orchestrarea tuturor activităților biologice este complexă și trebuie să funcționeze sinergic între ele.
1., Pugliese, Peter T. MD. (2005) Anexa A. enzime și activitate enzimatică. Îngrijire Profesională Avansată A Pielii-Ediția Medicală. p 390-392 agentul topic, LLC, Burnsville, PA
2. Enzimă. Wikipedia.org preluat de la https://en.wikipedia.org/wiki/Enzyme
3. Ibidem-Pugliese-Ref 1
4. Ibidem-Lavrikova p.
5. Autor Subcapitol: Petra Lavrikova. Capitolul 6. Enzime. Funcția celulelor și a corpului uman. Preluat de la http://fblt.cz/en/skripta/ii-premena-latek-a-energie-v-bunce/6-enzymy/
6. Ibidem-Lavrikova p.
7. Ibidem-Pugliese
8. Ibidem-a se vedea ref. 2
9. Reglarea Enzimelor., Biologie energie și enzime preluate de la https://www.khanacademy.org/science/biology/energy-and-enzymes/enzyme-regulation/a/enzyme-regulation
10. Inhibitor de enzimă preluat de la https://en.wikipedia.org/wiki/Enzyme_inhibitor
11. Insuficiență Pancreatică. Centrul de boli Digestive, Universitatea Medicală din Carolina de Sud. Preluat de la http://ddc.musc.edu/public/diseases/pancreas-biliary-system/pancreatic-insufficiency.html
12. Reglarea Enzimelor. Biologie energie și enzime. Khan Academy p. 2 preluat de la https://www.khanacademy.org/science/biology/energy-and-enzymes/enzyme-regulation/a/enzyme-regulation
13. Ibidem-Lavrikova, pg. 5
14. Snyder, Kimberly. (Decembrie 06 2017) modul în care enzimele afectează frumusețea și sănătatea. Preluat de la https://www.huffingtonpost.com/kimberly-snyder/enzymes-beauty-health_b_1201847.html
15. Ibidem-Pugliese pg 391
16., Ibidem-Lavrikova P 7
17. Preland, R., Rothnagel, J., Lawrence, O. (2006)Capitolul 9, Profilaggrin și Topit S100 Familie de Calciu-Proteine de Legare. Bariera pielii, Elias & Feingold.
18. Ekholm, E., Brattasnd, M., Egelrud, T. (Ian. 2000) enzima triptică a stratului cornos în epiderma normală: o legătură lipsă în procesul de descuamare? Jurnalul de Dermatologie investigativă, Vol 114, Numărul 1, PP 56-63 preluat de la https://www.sciencedirect.com/science/article/pii/S0022202X15407316
19. Ibidem-Pugliese-Ref 1
20. Ibidem-Ref 17, p. 56