objectifs D’apprentissage
à la fin de cette section, vous pourrez:
- définir des composés ioniques et moléculaires (covalents)
- prédire le type de composé formé à partir d’éléments en fonction de leur emplacement dans le tableau périodique
- déterminer réactions chimiques ordinaires, le noyau de chaque atome (et donc l’identité de l’élément) reste inchangé., Les électrons, cependant, peuvent être ajoutés aux atomes par transfert d’autres atomes, perdus par transfert à d’autres atomes ou partagés avec d’autres atomes. Le transfert et le partage des électrons entre les atomes régissent la chimie des éléments. Au cours de la formation de certains composés, les atomes gagnent ou perdent des électrons et forment des particules chargées électriquement appelées ions (Figure 1).
Vous pouvez utiliser le tableau périodique pour prédire si un atome forme un anion ou un cation, et vous pouvez souvent prédire la charge de l’ion résultante., Les atomes de nombreux métaux du groupe principal perdent suffisamment d’électrons pour leur laisser le même nombre d’électrons qu’un atome du gaz noble précédent. Pour illustrer, un atome d’un métal alcalin (groupe 1) perd un électron et forme un cation avec un+ 1 charge; un métal terreux (groupe 2) perd deux électrons et forme un cation avec une 2+ de charge, et ainsi de suite. Par exemple, un atome de calcium neutre, avec 20 protons et 20 électrons, perd facilement deux électrons. Il en résulte un cation avec 20 protons, 18 électrons et une charge 2+., Il a le même nombre d’électrons que les atomes du gaz noble précédent, l’argon, et est symbolisé Ca2+. Le nom d’un ion métallique est le même que le nom de l’atome de métal à partir duquel il se forme, donc Ca2+ est appelé un ion calcium.
lorsque les atomes d’éléments non métalliques forment des ions, ils gagnent généralement suffisamment d’électrons pour leur donner le même nombre d’électrons qu’un atome du gaz noble suivant dans le tableau périodique. Les atomes du groupe 17 gagnent un électron et forment des anions avec une charge 1; les atomes du groupe 16 gagnent deux électrons et forment des ions avec une charge 2, etc., Par exemple, l’atome de brome neutre, avec 35 protons et 35 électrons, peut gagner un électron pour lui fournir 36 électrons. Il en résulte un anion avec 35 protons, 36 électrons et une charge de 1. Il a le même nombre d’électrons que les atomes du gaz noble suivant, le krypton, et est symbolisé Br−. (Une discussion de la théorie soutenant le statut privilégié des nombres d’électrons de gaz noble reflété dans ces règles prédictives pour la formation d’ions est fournie dans un chapitre ultérieur de ce texte.)
notez l’utilité du tableau périodique pour prédire la formation et la charge d’ions probables (Figure 2)., Se déplaçant de l’extrême gauche vers la droite sur le tableau périodique, les éléments du groupe principal ont tendance à former des cations avec une charge égale au nombre de groupe. C’est-à-dire que les éléments du Groupe 1 forment 1+ ions; les éléments du groupe 2 forment 2+ ions, et ainsi de suite. Se déplaçant de l’extrême droite vers la gauche sur le tableau périodique, les éléments forment souvent des anions avec une charge négative égale au nombre de groupes déplacés à gauche des gaz nobles. Par exemple, les éléments du groupe 17 (un groupe à gauche des gaz nobles) forment des ions 1; les éléments du groupe 16 (deux groupes à gauche) forment des ions 2, etc., Cette tendance peut être utilisée comme guide dans de nombreux cas, mais sa valeur prédictive diminue lorsqu’on se déplace vers le centre du tableau périodique. En fait, les métaux de transition et certains autres métaux présentent souvent des charges variables qui ne sont pas prévisibles par leur emplacement dans le tableau. Par exemple, le cuivre peut former des ions avec une charge de 1+ ou 2+, et le fer peut former des ions avec une charge de 2+ ou 3+.
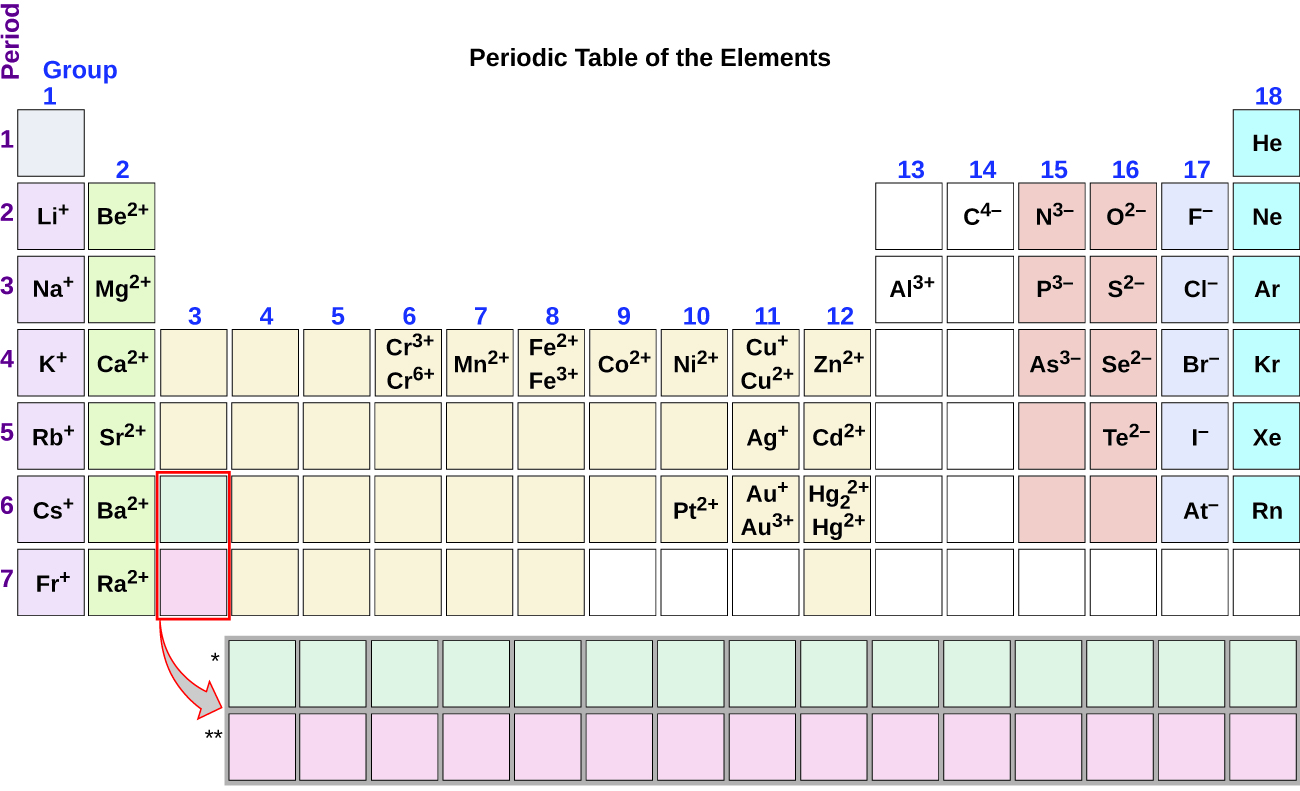
Figure 2. Certains éléments présentent un motif régulier de charge ionique lorsqu’ils forment des ions., Exemple 1
la Composition des Ions
Un ion trouve dans certains composés utilisés que les antisudorifiques contient 13 protons et 10 électrons. Quel est son symbole?Solution
étant donné que le nombre de protons reste inchangé lorsqu’un atome forme un ion, le numéro atomique de l’élément doit être 13. Sachant cela nous permet d’utiliser le tableau périodique pour identifier l’élément que Al (aluminium). L’atome Al a perdu trois électrons et a donc trois charges positives (13) de plus qu’il n’a d’électrons (10). C’est le cation aluminium, Al3+.,Vérifiez votre apprentissage
donnez le symbole et le nom de l’ion avec 34 protons et 36 électrons.Réponse:
Se2−, le séléniure d’ions
Exemple 2
la Formation d’Ions
de Magnésium et d’azote réagissent pour former un composé ionique. Prédire qui forme un anion, qui forme un cation, et les charges de chaque ion. Écrivez le symbole pour chaque ion et nommez-les.Solution
La position du magnésium dans le tableau périodique (groupe 2) nous indique qu’il s’agit d’un métal. Les métaux forment des ions positifs (cations)., Un atome de magnésium doit perdre deux électrons pour avoir le même nombre d’électrons qu’un atome du gaz noble précédent, le néon. Ainsi, un atome de magnésium formera un cation avec deux électrons de moins que les protons et une charge de 2+. Le symbole de l’ion Mg2+, et il est appelé un ion magnésium.La position de L’azote dans le tableau périodique (groupe 15) révèle qu’il s’agit d’un non-métal. Les non-métaux forment des ions négatifs (anions). Un atome d’azote doit gagner trois électrons pour avoir le même nombre d’électrons qu’un atome du gaz noble suivant, le néon., Ainsi, un atome d’azote formera un anion avec trois électrons de plus que les protons et une charge de 3−. Le symbole de l’ion est N3−, et il est appelé un ion nitrure.
Vérifiez votre apprentissage
L’aluminium et le carbone réagissent pour former un composé ionique. Prédire qui forme un anion, qui forme un cation, et les charges de chaque ion. Écrivez le symbole pour chaque ion et nommez-les.Réponse:
Al de former un cation avec une charge de 3+: Al3+, un ion aluminium. Le carbone formera un anion avec une charge de 4−: C4−, un ion carbure.,
Les ions dont nous avons parlé jusqu’à présent sont appelés ions monatomiques, c’est-à-dire qu’ils sont formés d’un seul atome. On trouve également de nombreux ions polyatomiques. Ces ions, qui agissent comme des unités discrètes, sont des molécules chargées électriquement (un groupe d’atomes liés avec une charge globale). Certains des ions polyatomiques les plus importants sont énumérés dans le tableau 6. Oxyanions sont des ions polyatomiques qui contiennent un ou plusieurs atomes d’oxygène. À ce stade de votre étude de la chimie, vous devez mémoriser les noms, les formules et les charges des ions polyatomiques les plus courants., Parce que vous les utiliserez à plusieurs reprises, ils deviendront bientôt familiers.
notez qu’il existe un système pour nommer certains ions polyatomiques; -ate et -te sont des suffixes désignant des ions polyatomiques contenant plus ou moins d’atomes d’oxygène. Per – (abréviation de « hyper ») et hypo- (signifiant” sous ») sont des préfixes signifiant plus d’atomes d’oxygène que-ate et moins d’atomes d’oxygène que -te, respectivement. Par exemple, le perchlorate est ClO4−, le chlorate est ClO3−, la chlorite est ClO2− et l’hypochlorite est ClO−., Malheureusement, le nombre d’atomes d’oxygène correspondant à un suffixe ou un préfixe donné n’est pas cohérent; par exemple, le nitrate est NO3− tandis que le sulfate est SO42−. Cela sera traité plus en détail dans le prochain module sur la nomenclature.
la nature des forces attractives qui maintiennent les atomes ou les ions ensemble dans un composé est la base de la classification de la liaison chimique. Lorsque les électrons sont transférés et que des ions se forment, il en résulte des liaisons ioniques., Les liaisons ioniques sont des forces d’attraction électrostatiques, c’est-à-dire les forces d’attraction ressenties entre des objets de charge électrique opposée (dans ce cas, des cations et des anions). Lorsque les électrons sont « partagés » et que des molécules se forment, il en résulte des liaisons covalentes. Liaisons covalentes sont les forces d’attraction entre les chargés positivement les noyaux des atomes liés et une ou plusieurs paires d’électrons qui sont situés entre les atomes. Les composés sont classés comme ioniques ou moléculaires (covalents) sur la base des liaisons présentes dans ceux-ci.,
Lorsqu’un élément composé d’atomes qui peuvent facilement perdre des électrons (un métal) réagit avec un élément composé d’atomes qui peuvent facilement gain d’électrons (un non-métal), un transfert d’électrons se produit généralement, produisant des ions. Le composé formé par ce transfert est stabilisé par les attractions électrostatiques (liaisons ioniques) entre les ions de charge opposée présents dans le composé., Par exemple, lors de chaque atome de sodium dans un échantillon de sodium métallique (groupe 1) cède un électron pour former un cations de sodium, Na+, et chaque atome de chlore dans un échantillon de gaz chloré (groupe 17) accepte un électron pour former un anion chlorure, Cl−, le composé résultant, NaCl, est composé d’ions sodium et d’ions chlorure dans le rapport de l’un de Na+ ion pour chaque ion Cl−. De même, chaque atome de calcium (groupe 2) peut céder deux électrons et en Transférer un à chacun des deux atomes de chlore pour former CaCl2, qui est composé d’ions Ca2+ et Cl− dans le rapport d’un ion Ca2+ à deux ions Cl−.,
Un composé qui contient des ions et est maintenu par liaison ionique est appelé un composé ionique. Le tableau périodique peut nous aider à reconnaître de nombreux composés ioniques: lorsqu’un métal est combiné avec un ou plusieurs non-métaux, le composé est généralement ionique. Cette ligne directrice fonctionne bien pour prédire la formation de composés ioniques pour la plupart des composés généralement rencontrés dans un cours d’introduction à la chimie. Cependant, il n’est pas toujours vrai (par exemple, le chlorure d’aluminium, AlCl3, n’est pas ionique).
Vous pouvez souvent reconnaître les composés ioniques en raison de leurs propriétés., Les composés ioniques sont des solides qui fondent généralement à des températures élevées et bouillent à des températures encore plus élevées. Par exemple, le chlorure de sodium fond à 801 °C et bout à 1413 °c. (à titre de comparaison, l’eau du composé moléculaire fond à 0 °C et bout à 100 °C.) sous forme solide, un composé ionique n’est pas électriquement conducteur car ses ions sont incapables de s’écouler (« électricité” est le flux de particules chargées). Une fois fondu, cependant, il peut conduire l’électricité parce que ses ions sont capables de se déplacer librement à travers le liquide (Figure 3).,

Figure 3. Le chlorure de Sodium fond à 801 °C et conduit l’électricité lorsqu’il est fondu. (crédit: modification de l’œuvre de Mark Blaser et Matt Evans) 
Regardez cette vidéo pour voir un mélange de sels de fonte et de conduire l’électricité.
dans chaque composé ionique, le nombre total de charges positives des cations est égal au nombre total de charges négatives des anions., Ainsi, les composés ioniques sont électriquement neutres dans l’ensemble, même s’ils contiennent des ions positifs et négatifs. Nous pouvons utiliser cette observation pour nous aider à écrire la formule d’un composé ionique. La formule d’un composé ionique doit avoir un rapport d’ions tel que les nombres de charges positives et négatives soient égaux.
exemple 3
prédire la formule d’un composé ionique
Le saphir de pierre gemme (Figure 4) est principalement un composé d’aluminium et d’oxygène qui contient des cations d’aluminium, Al3+, et des anions d’oxygène, O2−. Quelle est la formule de ce composé?,
Figure 4. Bien que l’oxyde d’aluminium pur soit incolore, des traces de fer et de titane donnent au saphir bleu sa couleur caractéristique. (crédit: modification du travail par Stanislav Doronenko) Solution
parce que le composé ionique doit être électriquement neutre, il doit avoir le même nombre de charges positives et négatives., Deux ions aluminium, chacun avec une charge de 3+, nous donnerait six charges positives, et trois oxyde les ions, chacun avec une charge de 2−, nous donnerait six charges négatives. La formule serait Al2O3.Vérifiez votre apprentissage
prédire la formule du composé ionique formé entre le cation sodique, Na+, et l’anion sulfure, S2−.Réponse:
Na2S
de Nombreux composés ioniques contiennent des ions polyatomiques (Tableau 6) que les cations, les anions, ou les deux., Comme pour les composés ioniques simples, ces composés doivent également être électriquement neutres, de sorte que leurs formules peuvent être prédites en traitant les ions polyatomiques comme des unités discrètes. Nous utilisons des parenthèses dans une formule pour indiquer un groupe d’atomes qui se comportent comme une unité. Par exemple, la formule du phosphate de calcium, l’un des minéraux de nos os, est Ca3(PO4)2. Cette formule indique qu’il y a trois ions calcium (Ca2+) pour deux groupes phosphate (PO43−). Les groupes PO43-sont des unités discrètes, chacune composée d’un atome de phosphore et de quatre atomes d’oxygène, et ayant une charge globale de 3−., Le composé est électriquement neutre, et sa formule montre un nombre total de trois atomes de Ca, deux p et huit O.
exemple 4
prédire la formule d’un composé avec un Anion polyatomique
La poudre à pâte contient du dihydrogénophosphate de calcium, un composé ionique composé des ions Ca2+ et H2PO4−. Quelle est la formule de ce composé?Solution
Les charges positives et négatives doivent s’équilibrer, et ce composé ionique doit être électriquement neutre. Ainsi, nous devons avoir deux charges négatives pour équilibrer la charge 2 + de l’ion calcium., Cela nécessite un rapport d’un ion Ca2+ pour deux ions H2PO4−. Nous le désignons en mettant entre parenthèses la formule de l’ion dihydrogénophosphate et en ajoutant un indice 2. La formule est Ca (H2PO4) 2.Vérifiez votre apprentissage
prédire la formule du composé ionique formé entre l’ion lithium et l’ion peroxyde, O22− (CONSEIL: Utilisez le tableau périodique pour prédire le signe et la charge sur l’ion lithium.,)Réponse:
Li2O2
comme un composé ionique est pas faite de simple, discret molécules, il peut ne pas être correctement symbolisé à l’aide d’une formule moléculaire. Au lieu de cela, les composés ioniques doivent être symbolisés par une formule indiquant le nombre relatif de ses ions constitutifs. Pour les composés contenant uniquement des ions monatomiques (tels que NaCl) et pour de nombreux composés contenant des ions polyatomiques (tels que CaSO4), ces formules ne sont que les formules empiriques introduites précédemment dans ce chapitre., Cependant, les formules de certains composés ioniques contenant des ions polyatomiques ne sont pas des formules empiriques. Par exemple, le composé ionique oxalate de sodium est composé D’ions Na+ et C2O42− combinés dans un rapport 2:1, et sa formule est écrite comme Na2C2O4. Les indices de cette formule ne sont pas les plus petits nombres entiers possibles, car chacun peut être divisé par 2 pour donner la formule empirique, NaCO2. Ce n’est pas la formule acceptée pour l’oxalate de sodium, cependant, car elle ne représente pas exactement l’anion polyatomique du composé, C2O42−.,
composés moléculaires
de nombreux composés ne contiennent pas d’ions mais sont constitués uniquement de molécules neutres et discrètes. Ces composés moléculaires (composés covalents) résultent lorsque les atomes partagent, plutôt que de transférer (gagner ou perdre), des électrons. La liaison covalente est un concept important et étendu en chimie, et elle sera traitée en détail dans un chapitre ultérieur de ce texte. Nous pouvons souvent identifier des composés moléculaires sur la base de leurs propriétés physiques., Dans des conditions normales, les composés moléculaires existent souvent sous forme de gaz, de liquides à bas point d’ébullition et de solides à bas point de fusion, bien que de nombreuses exceptions importantes existent.
alors que les composés ioniques sont généralement formés lorsqu’un métal et un non-métal combiner, covalente composés sont habituellement formés par une combinaison de nonmetals. Ainsi, le tableau périodique, peut nous aider à reconnaître de nombreux composés covalents., Bien que nous puissions utiliser les positions des éléments d’un composé dans le tableau périodique pour prédire s’il est ionique ou covalent à ce stade de notre étude de la chimie, vous devez savoir qu’il s’agit d’une approche très simpliste qui ne tient pas compte d’un certain nombre d’exceptions intéressantes. Des nuances de gris existent entre les composés ioniques et moléculaires, et vous en apprendrez plus plus tard.,
exemple 5
prédire le type de liaison dans les composés
prédire si les composés suivants sont ioniques ou moléculaires:(a) KI, le composé utilisé comme source d’iode dans le sel de table
(b) H2O2, l’eau de javel et le peroxyde d’hydrogène désinfectant
(c) source de lithium dans les antidépresseurs
solution
(a) le potassium(Groupe 1) est un métal et l’iode (groupe 17) est un non-métal; on prédit que le Ki est ionique.,(b) L’hydrogène (Groupe 1) est un non-métal, et l’oxygène (groupe 16) est un non-métal; H2O2 est prédit pour être moléculaire.
(c) le carbone (groupe 14) est un non-métal, l’hydrogène (Groupe 1) est un non-métal et le chlore (groupe 17) est un non-métal; CHCl3 est prédit pour être moléculaire.
(d) le Lithium (Groupe 1) est un métal, et le carbonate est un ion polyatomique; on prédit que Li2CO3 est ionique.,
Vérifiez votre apprentissage
En utilisant le tableau périodique, prédisez si les composés suivants sont ioniques ou covalents:(a) SO2
(b) CaF2
(c) N2H4
(d) Al2(SO4)3
réponse:
(a) moléculaire; (b) ionique; (c) moléculaire; (d) ioniques
concepts clés et résumé
Les métaux (en particulier ceux des groupes 1 et 2) ont tendance à perdre le nombre d’électrons qui leur laisserait le même nombre d’électrons que dans le gaz noble précédent dans le tableau périodique. Par ce moyen, un ion chargé positivement est formé., De même, les non-métaux (en particulier ceux des groupes 16 et 17 et, dans une moindre mesure, ceux du Groupe 15) peuvent gagner le nombre d’électrons nécessaires pour fournir aux atomes le même nombre d’électrons que dans le gaz noble suivant dans le tableau périodique. Ainsi, les non-métaux ont tendance à former des ions négatifs. Les ions chargés positivement sont appelés cations, et les ions chargés négativement sont appelés anions. Les Ions peuvent être monatomiques (ne contenant qu’un atome) ou polyatomiques (contenant plus d’un atome).
les Composés qui contiennent des ions sont appelés composés ioniques., Les composés ioniques se forment généralement à partir de métaux et de non-métaux. Les composés qui ne contiennent pas d’ions, mais sont plutôt constitués d’atomes liés étroitement ensemble dans des molécules (groupes d’atomes non chargés qui se comportent comme une seule unité), sont appelés composés covalents. Les composés covalents se forment généralement à partir de deux non-métaux.,composé ionique composé ionique composé composé de cations et d’anions combinés dans des rapports, donnant une substance électriquement neutre composé moléculaire (également composé covalent) composé de molécules formées par des atomes de deux ou plusieurs éléments différents ion monatomique ion composé d’un seul atome oxyanion anion polyatomique composé d’un atome central lié à des atomes d’oxygène ion polyatomique ion composé de plus d’un atome