Obiectivele de Învățare
Până la sfârșitul acestei secțiuni, veți fi capabili să:
- Defini ionice și moleculare (covalente) compuși
- Prezice tipul de compus format din elemente în funcție de locația lor în tabelul periodic
- Determina formulele de simplu compuși ionici
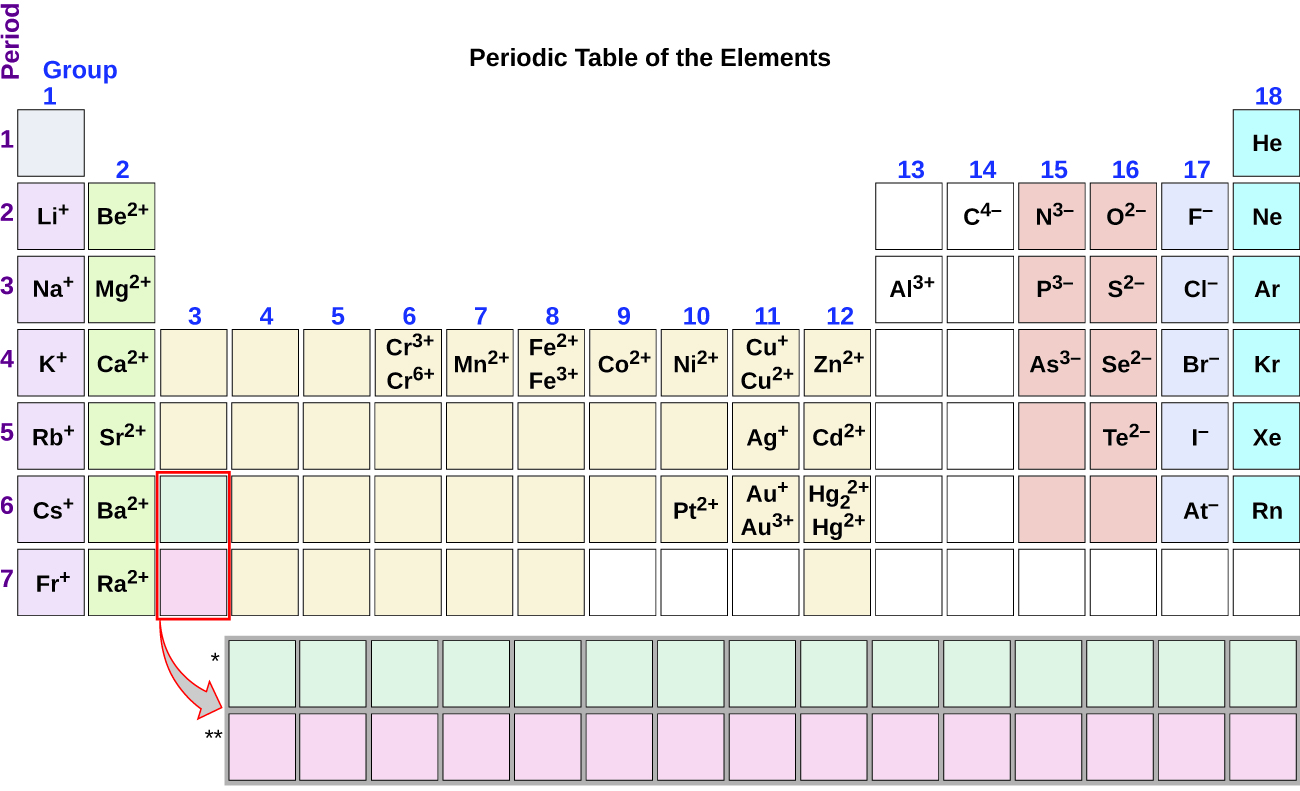
În obișnuite reacții chimice, nucleul fiecarui atom (și, astfel, identitatea element) rămâne neschimbată., Cu toate acestea, electronii pot fi adăugați la atomi prin transfer de la alți atomi, pierduți prin transfer la alți atomi sau împărțiți cu alți atomi. Transferul și împărțirea electronilor între atomi guvernează chimia elementelor. În timpul formării unor compuși, atomii câștigă sau pierd electroni și formează particule încărcate electric numite ioni (Figura 1).puteți utiliza tabelul periodic pentru a prezice dacă un atom va forma un anion sau un cation și puteți prezice adesea încărcarea ionului rezultat., Atomii multor metale din grupa principală pierd suficienți electroni pentru a le lăsa cu același număr de electroni ca un atom al gazului nobil precedent. Pentru a ilustra, un atom al unui metal alcalin (grupul 1) a pierde un electron și formează un cation cu o 1+ taxe; o alcalino-metal (grup 2) pierde doi electroni și formează un cation cu o 2+ charge, și așa mai departe. De exemplu, un atom de calciu neutru, cu 20 de protoni și 20 de electroni, pierde ușor doi electroni. Aceasta are ca rezultat un cation cu 20 de protoni, 18 electroni și o sarcină 2+., Are același număr de electroni ca atomii gazului nobil precedent, argon, și este simbolizat Ca2+. Numele unui ion metalic este același cu numele atomului metalic din care se formează, deci Ca2+ se numește ion de calciu.când atomii elementelor nemetale formează ioni, ei câștigă în general suficienți electroni pentru a le da același număr de electroni ca un atom al următorului gaz nobil din tabelul periodic. Atomii din grupa 17 câștigă un electron și formează anioni cu o sarcină 1; atomii din grupa 16 câștigă doi electroni și formează ioni cu o sarcină 2 și așa mai departe., De exemplu, atomul de brom neutru, cu 35 de protoni și 35 de electroni, poate obține un electron pentru a-i furniza 36 de electroni. Aceasta are ca rezultat un anion cu 35 de protoni, 36 de electroni și o sarcină 1. Are același număr de electroni ca și atomii următorului gaz nobil, krypton, și este simbolizat Br−. (O discuție a teoriei care susține statutul favorizat al numerelor de electroni de gaz nobil reflectată în aceste reguli predictive pentru formarea ionilor este furnizată într-un capitol ulterior al acestui text.notă utilitatea tabelului periodic în prezicerea formării și încărcării ionice probabile (Figura 2)., Trecând de la extrema stângă la dreapta pe tabelul periodic, elementele grupului principal tind să formeze cationi cu o sarcină egală cu numărul grupului. Adică elementele din grupa 1 formează ioni 1+; elementele din grupa 2 formează ioni 2+ și așa mai departe. Trecând de la extrema dreaptă la stânga pe tabelul periodic, elementele formează adesea anioni cu o sarcină negativă egală cu numărul de grupuri mutate la stânga din gazele nobile. De exemplu, elementele grupului 17 (un grup rămas din gazele nobile) formează ioni 1; elementele grupului 16 (două grupuri rămase) formează ioni 2 și așa mai departe., Această tendință poate fi utilizată ca ghid în multe cazuri, dar valoarea sa predictivă scade atunci când se deplasează spre centrul tabelului periodic. De fapt, metalele de tranziție și alte metale prezintă adesea sarcini variabile care nu sunt previzibile prin amplasarea lor în tabel. De exemplu, cuprul poate forma ioni cu o încărcare de 1+ sau 2+, iar fierul poate forma ioni cu o încărcare de 2+ sau 3+.
Exemplul 1
Compozitie de Ioni
Un ion găsit în unii compuși folosit ca antiperspirante conține 13 protoni și 10 electroni. Care este simbolul său?deoarece numărul de protoni rămâne neschimbat atunci când un atom formează un ion, numărul atomic al elementului trebuie să fie 13. Știind acest lucru ne permite să folosim tabelul periodic pentru a identifica elementul ca Al (aluminiu). Atomul Al a pierdut trei electroni și are astfel trei sarcini pozitive (13) decât are electroni (10). Acesta este cationul de aluminiu, Al3+.,
verificați învățarea
dați simbolul și numele ionului cu 34 de protoni și 36 de electroni.
răspuns:
SE2−, ionul selenid
Exemplul 2
formarea ionilor
magneziul și azotul reacționează pentru a forma un compus ionic. Preziceți care formează un anion, care formează un cation și încărcăturile fiecărui ion. Scrieți Simbolul pentru fiecare ion și numiți-le.poziția magneziului în tabelul periodic (Grupa 2) ne spune că este un metal. Metalele formează ioni pozitivi (cationi)., Un atom de magneziu trebuie să piardă doi electroni pentru a avea același număr de electroni ca un atom al gazului nobil anterior, neon. Astfel, un atom de magneziu va forma un cation cu doi electroni mai puțini decât protonii și o sarcină de 2+. Simbolul ionului este Mg2+ și se numește ion de magneziu.
poziția azotului în tabelul periodic (grupa 15) arată că este un nemetal. Nemetalele formează ioni negativi (anioni). Un atom de azot trebuie să câștige trei electroni pentru a avea același număr de electroni ca un atom al următorului gaz nobil, neon., Astfel, un atom de azot va forma un anion cu încă trei electroni decât protonii și o încărcătură de 3−. Simbolul ionului este N3-și se numește ion de nitrură.verificați învățarea aluminiul și carbonul reacționează pentru a forma un compus ionic. Preziceți care formează un anion, care formează un cation și încărcăturile fiecărui ion. Scrieți Simbolul pentru fiecare ion și numiți-le.
răspuns:
Al va forma un cation cu o sarcină de 3+: AL3+, un ion de aluminiu. Carbonul va forma un anion cu o încărcătură de 4−: C4 -, un ion de carbură.,ionii despre care am discutat până acum se numesc ioni monatomici, adică sunt ioni formați dintr-un singur atom. De asemenea, găsim mulți ioni poliatomici. Acești ioni, care acționează ca unități discrete, sunt molecule încărcate electric (un grup de atomi legați cu o sarcină globală). Unii dintre cei mai importanți ioni poliatomici sunt enumerați în Tabelul 6. Oxianionii sunt ioni poliatomici care conțin unul sau mai mulți atomi de oxigen. În acest moment în studiul dvs. de chimie, ar trebui să memorați numele, formulele și încărcăturile celor mai comuni ioni poliatomici., Pentru că le veți folosi în mod repetat, în curând se vor familiariza.rețineți că există un sistem de denumire a unor ioni poliatomici; -ate și-ite sunt sufixe care desemnează ioni poliatomici care conțin mai mulți sau mai puțini atomi de oxigen. Per – (prescurtarea de la” hyper”) și hypo- (care înseamnă” sub”) sunt prefixe care înseamnă mai mulți atomi de oxigen decât-ate și, respectiv, mai puțini atomi de oxigen decât-ite. De exemplu, percloratul este ClO4−, clorat este ClO3−, clorit este ClO2− și hipoclorit este ClO−., Din păcate, numărul de atomi de oxigen corespunzător unui sufix sau prefix dat nu este consecvent; de exemplu, nitratul este NO3− în timp ce sulfatul este SO42−. Acest lucru va fi acoperit mai detaliat în următorul modul privind Nomenclatura.natura forțelor atractive care dețin atomi sau ioni împreună într-un compus este baza pentru clasificarea legăturii chimice. Când electronii sunt transferați și se formează ioni, rezultă legături ionice., Legăturile ionice sunt forțe electrostatice de atracție, adică forțele atractive experimentate între obiecte de sarcină electrică opusă (în acest caz, cationi și anioni). Când electronii sunt „împărțiți” și se formează molecule, rezultă legături covalente. Legăturile covalente sunt forțele atractive dintre nucleele încărcate pozitiv ale atomilor legați și una sau mai multe perechi de electroni care se află între atomi. Compușii sunt clasificați ca ionici sau moleculari (covalenți) pe baza legăturilor prezente în ele.,când un element compus din atomi care pierd cu ușurință electroni (un metal) reacționează cu un element compus din atomi care câștigă cu ușurință electroni (un nemetal), apare de obicei un transfer de electroni, producând ioni. Compusul format prin acest transfer este stabilizat de atracțiile electrostatice (legăturile ionice) dintre ionii de sarcină opusă prezenți în compus., De exemplu, atunci când fiecare atom de sodiu dintr− o probă de metal de sodiu (grupa 1) renunță la un electron pentru a forma un cation de sodiu, Na+ și fiecare atom de clor dintr− o probă de gaz de clor (grupa 17) acceptă un electron pentru a forma un anion de clorură, Cl -, compusul rezultat, NaCl, este compus din ioni de sodiu și ioni de clorură în raportul În mod similar, fiecare atom de calciu (Grupa 2) poate renunța la doi electroni și poate transfera unul la fiecare dintre cei doi atomi de clor pentru a forma CaCl2, care este compus din ioni de Ca2+ și Cl în raportul dintre un ion de Ca2+ și doi ioni de Cl.,un compus care conține ioni și este ținut împreună prin legături ionice se numește compus ionic. Tabelul periodic ne poate ajuta să recunoaștem mulți dintre compușii care sunt ionici: atunci când un metal este combinat cu unul sau mai multe nemetale, compusul este de obicei ionic. Acest ghid funcționează bine pentru a prezice formarea compusului ionic pentru majoritatea compușilor întâlniți în mod obișnuit într-un curs introductiv de chimie. Cu toate acestea, nu este întotdeauna adevărat (de exemplu, clorura de aluminiu, AlCl3, nu este Ionică).puteți recunoaște adesea compușii ionici datorită proprietăților lor., Compușii ionici sunt solide care se topesc de obicei la temperaturi ridicate și se fierb la temperaturi chiar mai ridicate. De exemplu, clorura de sodiu se topește la 801 °C și fierbe la 1413 °C. (Ca o comparație, apa compusului molecular se topește la 0 °C și se fierbe la 100 °C.) În formă solidă, Un compus ionic nu este conductiv electric, deoarece ionii săi nu pot curge („electricitatea” este fluxul de particule încărcate). Cu toate acestea, atunci când este topit, poate conduce electricitatea, deoarece ionii săi sunt capabili să se miște liber prin lichid (Figura 3).,


Uita-te la acest videoclip pentru a vedea un amestec de săruri de topire și de a efectua de energie electrică.în fiecare compus ionic, numărul total de sarcini pozitive ale cationilor este egal cu numărul total de sarcini negative ale anionilor., Astfel, compușii ionici sunt în general neutri din punct de vedere electric, chiar dacă conțin ioni pozitivi și negativi. Putem folosi această observație pentru a ne ajuta să scriem formula unui compus ionic. Formula unui compus ionic trebuie să aibă un raport de ioni astfel încât numărul de sarcini pozitive și negative să fie egal.
Exemplul 3
prezicerea formulei unui compus Ionic
piatra prețioasă safir (Figura 4) este în mare parte un compus de aluminiu și oxigen care conține cationi de aluminiu, AL3+ și anioni de oxigen, O2−. Care este formula acestui compus?,

Soluție
Pentru că ionice trebuie să fie neutru electric, trebuie să aibă același număr de sarcinile pozitive și cele negative., Doi ioni de aluminiu, fiecare cu o sarcină de 3+, Ne− ar da șase sarcini pozitive, iar trei ioni de oxid, fiecare cu o sarcină de 2 -, Ne-ar da șase sarcini negative. Formula ar fi Al2O3.
verificați învățarea
preziceți formula compusului ionic format între cationul de sodiu, Na+ și anionul sulfurat, S2−.
răspuns:
Na2S
mulți compuși ionici conțin ioni poliatomici (Tabelul 6) ca cation, anion sau ambii., Ca simplu compuși ionici, acești compuși trebuie să fie, de asemenea, neutru electric, deci formulele lor poate fi prezis prin tratarea cu ioni polyatomic ca unități discrete. Folosim paranteze într-o formulă pentru a indica un grup de atomi care se comportă ca o unitate. De exemplu, formula pentru fosfatul de calciu, unul dintre mineralele din oasele noastre, este Ca3(PO4)2. Această formulă indică faptul că există trei ioni de calciu (Ca2+) pentru fiecare două grupuri de fosfat (PO43−). Grupurile PO43 sunt unități discrete, fiecare constând dintr−un atom de fosfor și patru atomi de oxigen și având o încărcătură totală de 3 -., Compusul este neutru din punct de vedere electric, iar formula sa arată un număr total de trei atomi Ca, doi P și opt O.
Exemplul 4
prezicerea formulei unui compus cu un Anion poliatomic
praful de copt conține dihidrogenofosfat de calciu, un compus ionic compus din ionii Ca2+ și H2PO4 -. Care este formula acestui compus?sarcinile pozitive și negative trebuie să se echilibreze, iar acest compus ionic trebuie să fie neutru din punct de vedere electric. Astfel, trebuie să avem două sarcini negative pentru a echilibra încărcarea 2+ a ionului de calciu., Aceasta necesită un raport de un ion Ca2+ la doi ioni H2PO4. Desemnăm acest lucru prin includerea formulei pentru ionul dihidrogenofosfat în paranteze și adăugarea unui indice 2. Formula este Ca (H2PO4) 2.
verificați învățarea
prezice formula compusului ionic format între ionul de litiu și ionul de peroxid, O22− (sugestie: utilizați tabelul periodic pentru a prezice semnul și încărcarea pe ionul de litiu.,)
răspuns:
Li2O2
deoarece un compus ionic nu este alcătuit din molecule unice, discrete, este posibil să nu fie simbolizat corespunzător folosind o formulă moleculară. În schimb, compușii ionici trebuie simbolizați printr-o formulă care indică numerele relative ale ionilor constituenți. Pentru compuși care conțin doar monatomic ioni (cum ar fi NaCl) și pentru mulți compuși care conțin ioni polyatomic (cum ar fi CaSO4), aceste formule sunt doar formule empirice introdus mai devreme în acest capitol., Cu toate acestea, formulele pentru unii compuși ionici care conțin ioni poliatomici nu sunt formule empirice. De exemplu, ionice oxalat de sodiu este compus din Na+ și C2O42− ioni combinate într-un raport de 2:1, iar formula sa este scris ca Na2C2O4. Indicatoarele din această formulă nu sunt cele mai mici numere întregi posibile, deoarece fiecare poate fi împărțit la 2 pentru a obține formula empirică, NaCO2. Aceasta nu este formula acceptată pentru oxalat de sodiu, totuși, deoarece nu reprezintă cu exactitate anionul poliatomic al compusului, C2O42−.,
compuși moleculari
mulți compuși nu conțin ioni, ci constau exclusiv din molecule discrete, neutre. Acești compuși moleculari (compuși covalenți) rezultă atunci când atomii împărtășesc, mai degrabă decât transferă (câștigă sau pierd), electroni. Legarea covalentă este un concept important și extins în chimie și va fi tratat în detaliu considerabil într-un capitol ulterior al acestui text. Putem identifica adesea compuși moleculari pe baza proprietăților lor fizice., În condiții normale, compușii moleculari există adesea ca gaze, lichide cu fierbere scăzută și solide cu topire scăzută, deși există multe excepții importante.în timp ce compușii ionici se formează de obicei atunci când un metal și o combinație nemetală, compușii covalenți sunt de obicei formați dintr-o combinație de nemetale. Astfel, tabelul periodic ne poate ajuta să recunoaștem mulți dintre compușii covalenți., În timp ce putem folosi pozițiile elementelor unui compus în tabelul periodic pentru a prezice dacă este ionic sau covalent în acest moment al studiului nostru de chimie, ar trebui să fiți conștienți că aceasta este o abordare foarte simplistă care nu ține cont de o serie de excepții interesante. Nuanțele de gri există între compușii ionici și moleculari și veți afla mai multe despre aceștia mai târziu.,
Exemplul 5
Estimarea Tipului de îmbinare în Compuși
Prezice dacă următorii compuși sunt ionice sau moleculare:
(o) KI, compus folosit ca o sursă de iod în sare de masă
(b) H2O2, inalbitor si dezinfectant peroxid de hidrogen
(c) CHCl3, anestezia cu cloroform
(d) Li2CO3, o sursă de litiu în antidepresive
Soluție
(a) de Potasiu (grupul 1) este un metal, și iod (grupa 17) este un nemetal; KI este prezis de a fi ionic.,
(b) hidrogenul (grupa 1) este un nemetal, iar oxigenul (grupa 16) este un nemetal; H2O2 este prezis a fi molecular.(c) carbonul (grupa 14) este un nemetal, hidrogenul (grupa 1) este un nemetal, iar clorul (grupa 17) este un nemetal; CHCl3 este prezis a fi molecular.(d) litiul (grupa 1) este un metal, iar carbonatul este un ion poliatomic; Li2CO3 este prezis a fi ionic.,
Verifica procesul de Învățare
Folosind tabelul periodic, prezice dacă următorii compuși sunt ionice sau covalente:
(o) SO2
(b) CaF2
(c) N2H4
(d) Al2(SO4)3
Răspuns:
(o) molecular; (b) ionic; (c) molecular; (d) ionic
Concepte-Cheie și Rezumatul
Metale (în special a celor din grupurile 1 și 2) tind să-și piardă numărul de electroni pe care le-ar lăsa cu același număr de electroni ca și în precedent gaz nobil în tabelul periodic. Prin aceasta se formează un ion încărcat pozitiv., În mod similar, nemetalele (în special cele din grupele 16 și 17 și, într-o măsură mai mică, cele din grupa 15) pot obține numărul de electroni necesari pentru a furniza atomilor același număr de electroni ca în următorul gaz nobil din tabelul periodic. Astfel, nemetalele tind să formeze ioni negativi. Ionii încărcați pozitiv se numesc cationi, iar ionii încărcați negativ se numesc anioni. Ionii pot fi monatomici (conținând doar un atom) sau poliatomici (conținând mai mult de un atom).compușii care conțin ioni se numesc compuși ionici., Compușii ionici se formează în general din metale și nemetale. Compușii care nu conțin ioni, ci constau în schimb din atomi legați strâns împreună în molecule (grupuri neîncărcate de atomi care se comportă ca o singură unitate), se numesc compuși covalenți. Compușii covalenți se formează de obicei din două nemetale.,lar compus) compus din molecule formate de atomii de două sau mai multe elemente diferite ionic bond forțe electrostatice de atracție între încărcate opus ionilor unui compus ionic ionic compus compus compus din cationi și anioni combinate în rapoarte, obținându-se un neutru electric substanță moleculară a compusului (de asemenea, compus covalent) compus din molecule formate de atomii de două sau mai multe elemente diferite monatomic ion ion compus dintr-un singur atom oxyanion polyatomic anioni compus dintr-un atom central legați la atomi de oxigen polyatomic ion ion compus din mai mult de un atom