Objetivos
Ao final desta seção, você será capaz de:
- Definir iônica e molecular (covalente) compostos
- Prever o tipo de composto formado a partir de elementos com base em sua localização na tabela periódica
- Determinar as fórmulas simples e compostos iónicos
Em comum reações químicas, o núcleo de cada átomo (e, portanto, a identidade do elemento) permanece inalterado., Elétrons, no entanto, podem ser adicionados aos átomos por transferência de outros átomos, perdidos por transferência para outros átomos, ou compartilhados com outros átomos. A transferência e partilha de elétrons entre os átomos governam a química dos elementos. Durante a formação de alguns compostos, os átomos ganham ou perdem elétrons, e formam partículas eletricamente carregadas chamadas íons (Figura 1).
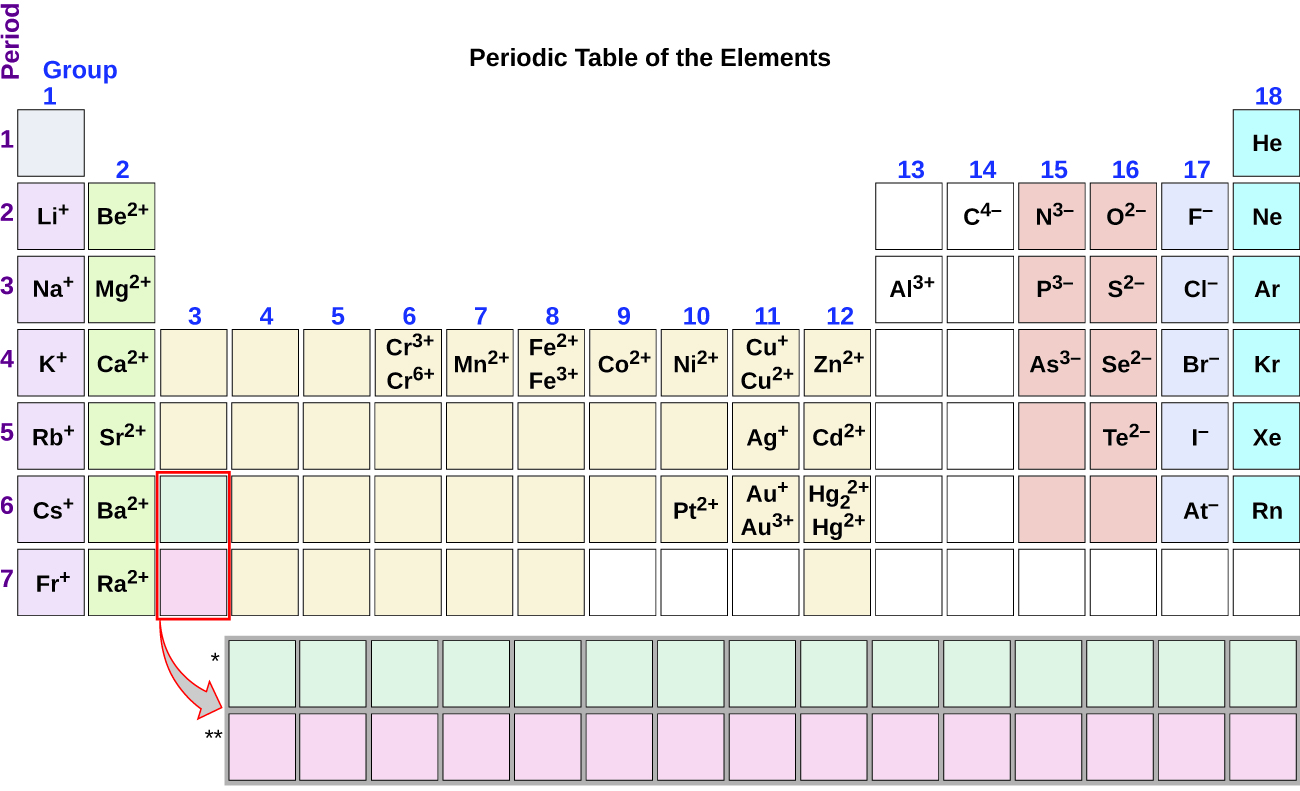
Você pode usar a tabela periódica para prever se um átomo irá formar um ânion ou um catião, e você pode muitas vezes prever a carga do íon resultante., Átomos de muitos metais do grupo principal perdem elétrons suficientes para deixá-los com o mesmo número de elétrons que um átomo do gás nobre anterior. Para ilustrar, um átomo de um metal alcalino (grupo 1) perde um elétron e forma um catião com uma carga 1+; um metal alcalino terrestre (grupo 2) perde dois elétrons e forma um catião com uma carga 2+, e assim por diante. Por exemplo, um átomo de cálcio neutro, com 20 protões e 20 electrões, perde facilmente dois electrões. Isto resulta em um catião com 20 prótons, 18 elétrons e uma carga 2+., Tem o mesmo número de elétrons que os átomos do gás nobre anterior, argônio, e é simbolizado Ca2+. O nome de um íon metálico é o mesmo que o nome do átomo de metal a partir do qual ele se forma, então Ca2+ é chamado de íon de cálcio.quando átomos de elementos não-metálicos formam íons, eles geralmente ganham elétrons suficientes para lhes dar o mesmo número de elétrons que um átomo do próximo gás nobre na tabela periódica. Átomos do grupo 17 ganham um elétron e formam aniões com uma carga de 1; átomos do grupo 16 ganham dois elétrons e formam íons com uma carga de 2, e assim por diante., Por exemplo, o átomo de bromo neutro, com 35 prótons e 35 elétrons, pode ganhar um elétron para fornecê-lo com 36 elétrons. Isto resulta em um ânion com 35 prótons, 36 elétrons e uma carga de 1. Tem o mesmo número de elétrons que os átomos do próximo gás nobre, krypton, e é simbolizado Br−. (A discussion of the theory supporting the favored status of noble gas electron numbers reflected in these predictive rules for ion formation is provided in a later chapter of this text.)
Note a utilidade da tabela periódica na previsão da provável formação de iões e carga (Figura 2)., Movendo-se da extrema esquerda para a direita na tabela periódica, os elementos do grupo principal tendem a formar catiões com uma carga igual ao número do grupo. Isto é, elementos do grupo 1 formam 1+ íons; elementos do grupo 2 formam 2+ íons, e assim por diante. Movendo-se da extrema direita para a esquerda na tabela periódica, elementos muitas vezes formam aniões com uma carga negativa igual ao número de grupos movidos para a esquerda dos gases nobres. Por exemplo, os elementos do grupo 17 (um grupo à esquerda dos gases nobres) formam 1− íons; os elementos do grupo 16 (dois grupos à esquerda) formam 2− íons, e assim por diante., Esta tendência pode ser usada como um guia em muitos casos, mas seu valor preditivo diminui quando se move para o centro da tabela periódica. Na verdade, metais de transição e alguns outros metais muitas vezes apresentam cargas variáveis que não são previsíveis pela sua localização na tabela. Por exemplo, o cobre pode formar íons com uma carga de 1+ ou 2+, e o ferro pode formar íons com uma carga de 2+ ou 3+.
Exemplo 1
Composição dos Íons
Um íon encontrado em alguns compostos utilizados como antitranspirantes contém 13 prótons e 10 elétrons. Qual é o seu símbolo?
solução
Porque o número de prótons permanece inalterado quando um átomo forma um íon, o número atômico do elemento deve ser 13. Saber isso nos permite usar a tabela periódica para identificar o elemento como Al (alumínio). O átomo de Al perdeu três elétrons e, portanto, tem mais três cargas positivas (13) do que tem elétrons (10). Este é o cátion de alumínio, Al3+.,
Verifique a sua aprendizagem
dê o símbolo e o nome para o íon com 34 prótons e 36 elétrons.
Resposta:
Se2−, o selenieto de íon
Exemplo 2
a Formação de Íons
Magnésio e nitrogênio reagem para formar um composto iónico. Predizer qual forma um anião, que forma um catião, e as cargas de cada íon. Escreva o símbolo de cada íon e nomeie-os.a posição do magnésio na tabela periódica (grupo 2) diz-nos que é um metal. Os metais formam íons positivos (catiões)., Um átomo de magnésio deve perder dois elétrons para ter o mesmo número de elétrons que um átomo do gás nobre anterior, neon. Assim, um átomo de magnésio formará um catião com dois elétrons a menos que prótons e uma carga de 2+. O símbolo para o íon é Mg2+, e é chamado de íon de magnésio.a posição do azoto na tabela periódica (grupo 15) revela que não é fetal. Não metálicos formam iões negativos (aniões). Um átomo de nitrogênio deve ganhar três elétrons para ter o mesmo número de elétrons que um átomo do gás nobre seguinte, neon., Assim, um átomo de nitrogênio formará um ânion com mais três elétrons do que prótons e uma carga de 3−. O símbolo para o íon é N3 -, e é chamado de íon nitreto.
Verifique a sua aprendizagem
alumínio e carbono reagem para formar um composto iônico. Predizer qual forma um anião, que forma um catião, e as cargas de cada íon. Escreva o símbolo de cada íon e nomeie-os.
resposta:
Al irá formar um catião com uma carga de 3+: Al3+, um íon de alumínio. O carbono formará um ânion com uma carga de 4 -: C4 -, um íon de carboneto.,
os íons que temos discutido até agora são chamados íons monatômicos, ou seja, eles são íons formados a partir de apenas um átomo. Também encontramos muitos íons poliatómicos. Estes íons, que agem como unidades discretas, são moléculas eletricamente carregadas (um grupo de átomos ligados com uma carga geral). Alguns dos íons poliatômicos mais importantes estão listados na Tabela 6. Oxianions são íons poliatômicos que contêm um ou mais átomos de oxigênio. Neste ponto do seu estudo de Química, você deve memorizar os nomes, fórmulas e cargas dos íons poliatômicos mais comuns., Porque você vai usá-los repetidamente, eles em breve se tornar familiar.
Note que existe um sistema para nomear alguns íons poliatômicos; – ate e-ite são sufixos designando íons poliatômicos contendo mais ou menos átomos de oxigênio. Per – (abreviação de “hyper”) e hypo- (significando “under”) são prefixos que significam mais átomos de oxigênio do que-ate e menos átomos de oxigênio do que-ite, respectivamente. Por exemplo, o perclorato é ClO4−, o clorato é ClO3−, o clorito é ClO2− e o hipoclorito é ClO−., Infelizmente, o número de átomos de oxigênio correspondente a um dado sufixo ou prefixo não é consistente; por exemplo, nitrato é NO3− enquanto sulfato é SO42−. Este aspecto será abordado de forma mais pormenorizada no próximo módulo sobre nomenclatura.
a natureza das forças atrativas que mantêm átomos ou íons juntos dentro de um composto é a base para classificar a ligação química. Quando os elétrons são transferidos e os íons se formam, as ligações iônicas resultam., Ligações iônicas são forças eletrostáticas de atração, ou seja, as forças atrativas experimentadas entre objetos de carga elétrica oposta (neste caso, catiões e aniões). Quando os elétrons são “compartilhados” e as moléculas se formam, as ligações covalentes resultam. Ligações covalentes são as forças atrativas entre os núcleos positivamente carregados dos átomos ligados e um ou mais pares de elétrons que estão localizados entre os átomos. Os compostos são classificados como iónicos ou moleculares (covalentes) com base nas ligações neles presentes.,quando um elemento composto por átomos que rapidamente perdem elétrons (um metal) reage com um elemento composto por átomos que rapidamente ganham elétrons (um não metal), uma transferência de elétrons geralmente ocorre, produzindo íons. O composto formado por esta transferência é estabilizado pelas atrações eletrostáticas (ligações iônicas) entre os íons de carga oposta presentes no composto., Por exemplo, quando cada átomo de sódio em uma amostra de metal de sódio (grupo 1) dá até um elétron para formar um de sódio cátions Na+, e cada átomo de cloro em uma amostra de gás cloro (grupo 17) aceita um elétron para formar um ânion cloreto, Cl−, o composto resultante, NaCl, é composta de íons de sódio e íons de cloreto na proporção de uma de Na+ para cada íon Cl− ion. Similarmente, cada átomo de cálcio (grupo 2) pode dar dois elétrons e transferir um para cada um dos dois átomos de cloro para formar CaCl2, que é composto de Ca2+ e Cl− ions na razão de um íon Ca2+ para dois Cl− ions.,
um composto que contém íons e é mantido junto por ligações iônicas é chamado de composto iônico. A tabela periódica pode nos ajudar a reconhecer muitos dos compostos que são iônicos: quando um metal é combinado com um ou mais não-metálicos, o composto é geralmente iônico. Esta diretriz funciona bem para prever a formação de compostos iônicos para a maioria dos compostos tipicamente encontrados em um curso de química introdutória. No entanto, nem sempre é verdade (por exemplo, cloreto de alumínio, AlCl3, não é iônico).
pode muitas vezes reconhecer compostos iónicos devido às suas propriedades., Compostos iônicos são sólidos que tipicamente derretem a altas temperaturas e fervem a temperaturas ainda mais altas. Por exemplo, cloreto de sódio, derrete na 801 °C e ferve a 1413 °C. (Como comparação, o composto molecular da água derrete a 0 °C e ferve a 100 °C.) Na forma sólida, um composto iónico, não é eletricamente condutiva porque seus íons são incapazes de fluxo (“luz” é o fluxo de partículas carregadas). Quando fundido, no entanto, pode conduzir electricidade porque os seus íons são capazes de se mover livremente através do líquido (Figura 3).,


Assista a este vídeo para ver uma mistura de sais de derretimento e de conduzir eletricidade.
em cada composto iônico, o número total de cargas positivas dos catiões é igual ao número total de cargas negativas dos aniões., Assim, os compostos iônicos são eletricamente neutros em geral, embora contenham íons positivos e negativos. Podemos usar esta observação para nos ajudar a escrever a fórmula de um composto iônico. A fórmula de um composto iônico deve ter uma razão de íons tal que os números de cargas positivas e negativas são iguais.
exemplo 3
Predicting the Formula of an Ionic Compound
The gemstone sapphire (Figure 4) is mostly a compound of aluminum and oxygen that contains aluminum cations, Al3+, and oxygen anions, O2−. Qual é a fórmula deste composto?,

Solução:
Porque o composto iónico, deve ser eletricamente neutro, ele deve ter o mesmo número de cargas positivas e negativas., Dois íons de alumínio, cada um com uma carga de 3+, Dar− nos-ia seis cargas positivas, e três íons de óxido, cada um com uma carga de 2 -, dar-nos-ia seis cargas negativas. A fórmula seria Al2O3.
Check Your Learning
Predict the formula of the ionic compound formed between the sodium cation, Na+, and the sulfide anion, S2−.
resposta:
Na2S
muitos compostos iónicos contêm iões poliatómicos (Quadro 6) como catião, ânion ou ambos., Como com compostos iônicos simples, estes compostos também devem ser eletricamente neutros, de modo que suas fórmulas podem ser previstas tratando os íons poliatômicos como unidades discretas. Usamos parênteses numa fórmula para indicar um grupo de átomos que se comportam como uma unidade. Por exemplo, a fórmula para fosfato de cálcio, um dos minerais em nossos ossos, é Ca3(PO4)2. Esta fórmula indica que existem três iões de cálcio (Ca2+) para cada dois grupos fosfato (PO43−). Os grupos PO43 são unidades discretas, cada uma consistindo de um átomo de fósforo e quatro átomos de oxigênio, e tendo uma carga geral de 3−., O composto é eletricamente neutro, e sua fórmula mostra uma contagem total de três átomos Ca, dois P e oito o.
exemplo 4
Predicting the Formula of a Compound with a Polyatomic Anion
Fering powder contains Calci dihidrogen phosphate, an ionic composed of the ions Ca2+ and H2PO4 -. Qual é a fórmula deste composto?
solução
As cargas positivas e negativas devem Balancear, e este composto iônico deve ser eletricamente neutro. Assim, devemos ter duas cargas negativas para equilibrar a carga 2+ do íon de cálcio., Isto requer uma relação de um íon Ca2+ para dois íons H2PO4. Nós designamos isso, anexando a fórmula para o íon di-hidrogenofosfato em parênteses e adicionando um índice 2. A fórmula é Ca (H2PO4)2.
Verifique a sua aprendizagem
prever a fórmula do composto iónico formado entre o ião lítio e o ião peróxido, O22− (Dica: Use a tabela periódica para prever o sinal e a carga sobre o ião lítio.,)
resposta:
Li2O2
porque um composto iónico não é constituído por moléculas únicas e discretas, pode não ser devidamente simbolizado usando uma fórmula molecular. Em vez disso, compostos iônicos devem ser simbolizados por uma fórmula que indique os números relativos de seus íons constituintes. Para compostos contendo apenas íons monoatômicos (tais como NaCl) e para muitos compostos contendo polyatomic íons (como CaSO4), estas fórmulas são apenas as fórmulas empíricas apresentado anteriormente neste capítulo., Entretanto, as fórmulas para alguns compostos iônicos contendo íons poliatômicos não são fórmulas empíricas. Por exemplo, o composto iônico oxalato de sódio é composto de na+ E C2O42− ions combinados em uma razão de 2:1, e sua fórmula é escrita como Na2C2O4. Os índices nesta fórmula não são os números inteiros menores possíveis, pois cada um pode ser dividido por 2 para produzir a fórmula empírica, NaCO2. Esta não é a fórmula aceita para oxalato de sódio, no entanto, como não representa com precisão o anião poliatômico do composto, C2O42−.,
compostos moleculares
muitos compostos não contêm íons, mas consistem apenas em moléculas discretas e neutras. Estes compostos moleculares (compostos covalentes) resultam quando os átomos compartilham, ao invés de transferência (ganho ou perda), elétrons. A ligação covalente é um conceito importante e extenso em química, e será tratado em detalhes consideráveis em um capítulo posterior deste texto. Podemos frequentemente identificar compostos moleculares com base nas suas propriedades físicas., Em condições normais, compostos moleculares muitas vezes existem como gases, líquidos de baixa ebulição e sólidos de baixa fusão, embora existam muitas exceções importantes.enquanto compostos iónicos são normalmente formados quando um metal e uma combinação não fetal, os compostos covalentes são normalmente formados por uma combinação de não-metais. Assim, a tabela periódica pode nos ajudar a reconhecer muitos dos compostos que são covalentes., Embora possamos usar as posições dos elementos de um composto na tabela periódica para prever se ele é Jônico ou covalente neste ponto em nosso estudo de Química, você deve estar ciente de que esta é uma abordagem muito simplista que não conta para uma série de exceções interessantes. Existem tons de cinza entre compostos iônicos e moleculares, e você aprenderá mais sobre eles mais tarde.,
Exemplo 5
Prever o Tipo de Ligação em Compostos
Prever se os seguintes compostos iônicos ou moleculares:
(a) KI, o composto usado como uma fonte de iodo no sal de mesa
(b) H2O2, o alvejante e desinfetante de peróxido de hidrogênio
(c) CHCl3, o anestésico clorofórmio
(d) Li2CO3, uma fonte de lítio em antidepressivo
Solução:
(a) de Potássio (grupo 1) é um metal, e iodo (grupo 17) é um metalóide; KI está previsto para ser iônica.,
(B) hidrogênio (grupo 1) é um não-metal, e oxigênio (grupo 16) é um não-metal; H2O2 é previsto para ser molecular.
(c) carbono (grupo 14) é um não-metal, hidrogênio (grupo 1) é um não-metal, e cloro (grupo 17) é um não-metal; CHCl3 é previsto para ser molecular.
(d) lítio (grupo 1) é um metal, e carbonato é um íon poliatômico; Li2CO3 é previsto para ser iônico.,
Verifique a Sua Aprendizagem
Usando a tabela periódica, prever se os seguintes compostos são iônica ou covalente:
(a) SO2
(b) CaF2
(c) N2H4
(d) Al2(SO4)3
Resposta:
(a) molecular; (b) iônica; (c) massa molecular; (d) iônica
Conceitos-Chave e Resumo
Metais (especialmente aqueles em grupos 1 e 2) tendem a perder o número de elétrons que iria deixá-los com o mesmo número de elétrons, como no anterior gases nobres da tabela periódica. Por este meio, um íon carregado positivamente é formado., Similarmente, não-metais (especialmente os dos grupos 16 e 17, e, em menor extensão, os do Grupo 15) podem ganhar o número de elétrons necessários para fornecer átomos com o mesmo número de elétrons como no próximo gás nobre na tabela periódica. Assim, não-metálicos tendem a formar íons negativos. Íons positivamente carregados são chamados catiões, e íons negativamente carregados são chamados aniões. Os íons podem ser monatômicos (contendo apenas um átomo) ou poliatômicos (contendo mais de um átomo).os compostos que contêm iões são chamados compostos iónicos., Compostos iónicos geralmente formam-se a partir de metais e não metálicos. Compostos que não contêm íons, mas consistem em átomos ligados firmemente em moléculas (grupos não carregados de átomos que se comportam como uma única unidade), são chamados compostos covalentes. Compostos covalentes geralmente formam-se a partir de dois não-metais.,lar composto) composto de moléculas formadas por átomos de dois ou mais elementos diferentes iônica bond forças eletrostáticas de atração entre as oposta carregadas de íons de um composto iónico iônica composto composto composto de catiões e aniões, combinados em proporções, produzindo uma eletricamente neutro substância molecular do composto (também composto covalente) composto de moléculas formadas por átomos de dois ou mais elementos diferentes de íons monoatômicos íon composto de um único átomo oxyanion polyatomic ânion composta de um átomo central ligado a átomos de oxigênio polyatomic íon íon composto de mais de um átomo