Las enzimas son moléculas orgánicas específicas que se encuentran en los sistemas biológicos que permiten que la vida celular exista y funcione a temperaturas terrestres. La mayoría de las reacciones químicas que sustentan la vida solo podrían ocurrir por encima de 90 ° C o 200 ° F en ausencia de enzimas. Las enzimas se conocen como catalizadores biológicos macromoleculares. Permiten la existencia de reacciones que no ocurrirían de otra manera en numerosas condiciones que tienen que ver con la temperatura, el pH y las condiciones atmosféricas dentro del cuerpo humano., Los procesos metabólicos dentro de las células requieren catalizadores enzimáticos para ocurrir a velocidades lo suficientemente rápidas como para soportar la vida. Se sabe que las enzimas catalizan más de 5.000 tipos de reacciones bioquímicas. El estudio de este tema complejo se llama enzimología.
 las enzimas aceleran la velocidad de reacción química de numerosas maneras, reduciendo la energía de activación. La energía de activación es la energía que debe estar disponible para un sistema químico o nuclear con reactivos potenciales para producir una reacción o producto. Las enzimas reaccionan con otras sustancias, ya sea para separarlas o unirlas., No alterar la posición del equilibrio químico de la reacción.
las enzimas aceleran la velocidad de reacción química de numerosas maneras, reduciendo la energía de activación. La energía de activación es la energía que debe estar disponible para un sistema químico o nuclear con reactivos potenciales para producir una reacción o producto. Las enzimas reaccionan con otras sustancias, ya sea para separarlas o unirlas., No alterar la posición del equilibrio químico de la reacción.
durante la presencia de una enzima, la reacción se mueve en la misma dirección que lo haría sin la enzima, sin embargo la presencia de la enzima acelera el proceso.
función y naturaleza de las enzimas
Las enzimas son responsables de:
1. Transducción de señales y regulación celular a menudo por quinasas y fosfatasas.
2. Generando movimiento con miosina (proteína muscular) hidrolizando ATP para generar contracción muscular.3. Transporte de carga alrededor de la célula como parte del citoesqueleto.
4., Digestión, metabolismo,respiración
5. Las enzimas digestivas como las amilasas y la proteasa descomponen moléculas grandes de almidones o proteínas en otras más pequeñas para una absorción adecuada en los intestinos.
6. Producción de hormonas.
7. Absorción y transporte de nutrientes.
8. Reparación y división celular.
9. Desintoxicación
10. Enfermedad: los virus pueden contener enzimas para infectar las células, es decir, la integrasa del VIH y la transcriptasa inversa.
enzimas
1. Estabilizar el estado de transición: a. , Crear un entorno con una distribución de carga complementaria a la del Estado de transición para reducir su energía.
2. Proporcionar una vía de reacción alternativa: a. reacciona temporalmente con el sustrato, formando un intermediario covalente para proporcionar un estado de transición de energía más bajo.3. Desestabiliza el estado fundamental del sustrato: a. distorsiona las restas enlazadas en su forma de estado de transición para reducir la energía requerida para alcanzar el estado de Transición. B. orientar los sustratos en una disposición productiva para reducir el cambio de entropía de reacción (termodinámica).,
Las enzimas esencialmente reaccionan con otras sustancias, ya sea para separarlas o unirlas.
Las enzimas se dividen como:
1. Simple: contiene solamente la parte proteica (por ejemplo, hidrolasas como pepsina, tripsina o ribonucleasa).
2. Complejo: las proteínas se pueden unir con una parte no proteica, conocida como grupos protésicos. La parte proteica se llama apoenzima. La parte no proteica se conoce como Cofactor. Juntos, la apoenzima y el Cofactor, forman una molécula biológicamente activa de la enzima: la holoenzima.cofactores: a., Ion metálico: ayuda a la enzima a posicionar la molécula de sustrato en el sitio activo. Llamados activadores, los metales asociados pueden incluir cobre, cobalto, zinc, magnesio, molibdeno y manganeso.
b. molécula orgánica: a menudo vitaminas como la riboflavina, las vitaminas B y la vitamina C.
C. coenzimas: una molécula orgánica no proteica que se une a la molécula de apoenzima libremente, por lo tanto puede separarse de ella, es decir, NAD+ (nicotinamida adenina dinucleótido) y NADP+ (nicotinamida adenina dinucleótido fosfato). NAD+ y NADP + son portadores de electrones en la respiración celular., NADP + se crea en reacción anabólica, o reacción que construye moléculas grandes a partir de moléculas pequeñas.
D. grupo prostético: una molécula orgánica no proteica que se une a la molécula de apoenzima firmemente, es decir, heme, FAD (flavin adenine dinucleotide)
un sustrato
Las moléculas sobre las que reaccionan las enzimas se denominan sustrato. La enzima permanece intacta y no se consume durante las reacciones químicas. Tampoco alteran la estabilidad de una reacción. En cambio, apoyan la progresión de una reacción manteniendo el equilibrio., La mayoría de las enzimas son proteínas compuestas de aminoácidos, los bloques de construcción básicos dentro del cuerpo. hay excepciones con algunos tipos de moléculas de ARN llamadas ribozimas. Las moléculas de aminoácidos están conectadas a través de enlaces conocidos como enlaces peptídicos que forman proteínas.
Las enzimas se componen de un número diferente de cadenas peptídicas y se denominan complejos multienzimáticos. Un ejemplo de complejos multienzimáticos sería la sintasa de ácidos grasos, una enzima que cataliza la síntesis de ácidos grasos superiores en las células., Químicamente, los pequeños grupos de aminoácidos unidos se llaman moléculas poliméricas o se refieren en la bioquímica como péptidos poli. se necesitan 30 aminoácidos para formar una cadena lo suficientemente larga que permita a las moléculas influir en su propia forma para convertirse en una proteína. Ya sea una cadena o varias cadenas, contiene varias partes llamadas dominios. Las proteínas cumplen numerosas funciones bioquímicas, incluyendo características estructurales anatómicas en organismos, portadores de nutrientes, antígenos y hormonas.,
El complejo enzima – sustrato
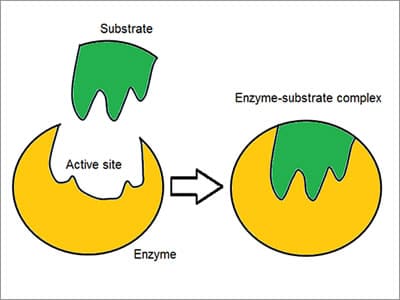 acuñado como un modelo de «bloqueo y llave», las enzimas reaccionan con otras sustancias para separarlas o unirlas. Hay una alta especificidad de las enzimas demostrada por la forma en que se asocian o unen con el sustrato: la molécula reactante. Quimioselectiva, cada molécula enzimática tiene un sitio activo en su superficie. La molécula reactante es atraída y moldeada en la hendidura que forma el sitio activo., la especificidad se logra mediante la Unión de bolsas con características complementarias, de forma, de carga y hidrofílicas / hidrofóbicas a los sustratos. El sitio activo continúa cambiando hasta que el sustrato está completamente Unido, dando como resultado una forma final. dicho esto, las enzimas son estructuras flexibles y el sitio activo se remodela continuamente por interacción con el sustrato a medida que interactúa con la enzima.control de la actividad enzimática las enzimas guían y regulan el metabolismo de una célula y son cuidadosamente controladas., El mecanismo de acción de las enzimas implica moléculas reguladoras que pueden aumentar (activador) o inhibir (inhibidores) la actividad de una enzima. Un inhibidor enzimático es una molécula que se une a una enzima y bloquea la Unión de un sustrato, disminuyendo su actividad. Si una enzima produce demasiado de una sustancia en un organismo, esa sustancia comienza a actuar como un inhibidor de la enzima al comienzo de la vía como una forma de retroalimentación negativa, ralentizando la reacción. Los medicamentos pueden ser inhibidores enzimáticos., Por ejemplo, bloquear la actividad de una enzima puede matar un patógeno o corregir un desequilibrio metabólico.
acuñado como un modelo de «bloqueo y llave», las enzimas reaccionan con otras sustancias para separarlas o unirlas. Hay una alta especificidad de las enzimas demostrada por la forma en que se asocian o unen con el sustrato: la molécula reactante. Quimioselectiva, cada molécula enzimática tiene un sitio activo en su superficie. La molécula reactante es atraída y moldeada en la hendidura que forma el sitio activo., la especificidad se logra mediante la Unión de bolsas con características complementarias, de forma, de carga y hidrofílicas / hidrofóbicas a los sustratos. El sitio activo continúa cambiando hasta que el sustrato está completamente Unido, dando como resultado una forma final. dicho esto, las enzimas son estructuras flexibles y el sitio activo se remodela continuamente por interacción con el sustrato a medida que interactúa con la enzima.control de la actividad enzimática las enzimas guían y regulan el metabolismo de una célula y son cuidadosamente controladas., El mecanismo de acción de las enzimas implica moléculas reguladoras que pueden aumentar (activador) o inhibir (inhibidores) la actividad de una enzima. Un inhibidor enzimático es una molécula que se une a una enzima y bloquea la Unión de un sustrato, disminuyendo su actividad. Si una enzima produce demasiado de una sustancia en un organismo, esa sustancia comienza a actuar como un inhibidor de la enzima al comienzo de la vía como una forma de retroalimentación negativa, ralentizando la reacción. Los medicamentos pueden ser inhibidores enzimáticos., Por ejemplo, bloquear la actividad de una enzima puede matar un patógeno o corregir un desequilibrio metabólico.
el control de la actividad enzimática es esencial para la homeostasis en el cuerpo. Cuando hay un mal funcionamiento de una enzima como una mutación, sobre o bajo producción, o deleción, esto puede conducir a una enfermedad genética. En algunos casos, puede ser fatal. Por ejemplo, la insuficiencia pancreática es una condición que ocurre cuando el páncreas no produce suficiente cantidad de una enzima específica necesaria para digerir los alimentos en el intestino delgado.,
Tabla 1-factores que afectan o controlan la actividad enzimática

modulación de temperatura
la actividad catalítica de las enzimas requiere una temperatura óptima dentro del cuerpo. Las enzimas humanas tienen actividad máxima a 37oC. Las enzimas pueden volverse vulnerables a los cambios de temperatura. Debido a su naturaleza proteica, la aplicación de altas temperaturas entre 55-60o C provoca la desnaturalización de la proteína, produciendo un cambio conformacional y destrucción de la proteína. Este cambio causa una caída o una detención completa de la reacción., Además, las bajas temperaturas pueden ralentizar las reacciones, reduciendo la actividad de las enzimas.
Ph
Las enzimas son sensibles al cambio en el pH. al igual que en los cambios de temperatura, los extremos de bajo y alto nuevamente conducen a la desnaturalización de las moléculas. La concentración de H + afecta la ionización de los grupos ácidos y bajos
fuentes enzimáticas
1. Enzimas metabólicas: regula órganos, tejidos y sangre. Ayuda a crear nuevas células, repara las células dañadas existentes y mueve los nutrientes a donde más los necesita tu cuerpo.
2. Enzimas digestivas: descompone los alimentos. Subtipos-amilasa, lipasa, proteasa
3., Alimentos crudos: apoya el sistema inmunológico, reparación celular.hay seis clases principales de enzimas con función específica. También hay subgrupos.
Tabla 2-tipos de enzimas 
subgrupos de enzimas:
Las hidrolasas son enzimas que dividen el agua, separando las partes de las moléculas.las Hidrogenasas son enzimas que agregan átomos de hidrógeno a otras moléculas; 5 alfa reductasa es un ejemplo.las oxidasas catalizan las oxidaciones agregando oxígeno o electrones a moléculas o átomos.,
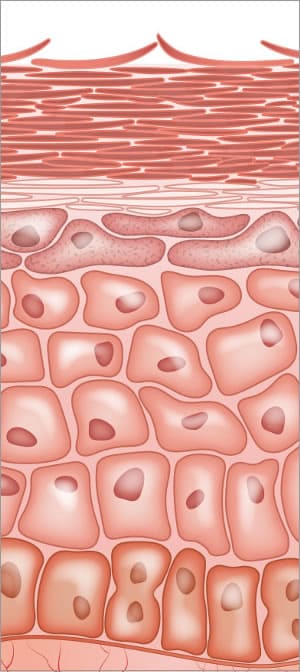 enzimas en la piel; construcción de la barrera de la piel y el proceso final de descamación
enzimas en la piel; construcción de la barrera de la piel y el proceso final de descamación
todo el proceso de diferenciación epidérmica depende de la actividad enzimática. Las hidrolasas lipídicas son responsables de la conversión de los lípidos en ceramidas y ácidos grasos libres. Las enzimas están involucradas en la modificación de profilaggrina y el procesamiento proteolítico en la epidermis. Las fases de Transición saludables de todo el proceso de construcción del estrato córneo son vitales y dependen de las enzimas.,las enzimas de proteasa son esenciales para el proceso normal de descamación dentro de las células del estrato córneo (SC). Los desmosomas son importantes para una fuerte adhesión de célula a célula. El proceso de descamación implica la proteólisis de las estructuras adhesivas intercelulares creadas en las estructuras del desmosoma. Hay enzimas proteasas específicas dentro del estrato córneo llamadas enzima triptica y enzima quimotriptica involucradas con la degradación de los corneodesmosomas. Dos proteínas que se encuentran en los desmosomas son la desmogleína y la desmocolina, ubicadas en las interconexiones dentro de las células.,
la enzima quimotriptica estrato córneo se produce como un precursor inactivo sin actividad proteolítica. Por lo tanto, hay un requisito de una enzima activadora que involucra una enzima con sustrato similar a la tripsina. Diferentes proteasas atacan los diferentes sitios de aminoácidos en las proteínas desmoglein y desmocollin. Cuando los enlaces se debilitan, se rompen, permitiendo que las células se desprendan. el proceso de descamación requiere agua desde dentro de la epidermis y un pH normal. la orquestación de todas las actividades biológicas es compleja y debe trabajar sinérgicamente entre sí.
1., Pugliese, Peter T. MD. (2005) Apéndice A. enzimas y actividad enzimática. Cuidado De La Piel Profesional Avanzado-Edición Médica. p 390-392 the Topical Agent, LLC, Burnsville, PA
2. Enzima. Wikipedia.org recuperado de https://en.wikipedia.org/wiki/Enzyme
3. IBID-Pugliese-Ref 1
4. IBID-Lavrikova p.
5. Autor Del Subcapítulo: Petra Lavrikova. Capítulo 6. Enzima. Función de las células y el cuerpo humano. Recuperado de http://fblt.cz/en/skripta/ii-premena-latek-a-energie-v-bunce/6-enzymy/
6. IBID-Lavrikova p.
7. IBID-Pugliese
8. Ibíd., véase ref. 2
9. Regulación Enzimática., Biología energía y enzimas recuperadas de https://www.khanacademy.org/science/biology/energy-and-enzymes/enzyme-regulation/a/enzyme-regulation
10. Inhibidor enzimático obtenido de https://en.wikipedia.org/wiki/Enzyme _inhibitor
11. Insuficiencia Pancreática. Centro de Enfermedades Digestivas, Universidad Médica de Carolina del Sur. Recuperado de http://ddc.musc.edu/public/diseases/pancreas-biliary-system/pancreatic-insufficiency.html
12. Regulación Enzimática. Biología energía y enzimas. Khan Academy p. 2 Retrieved from https://www.khanacademy.org/science/biology/energy-and-enzymes/enzyme-regulation/a/enzyme-regulation
13. IBID-Lavrikova, pg. 5
14. Snyder, Kimberly. (06 de diciembre de 2017) Cómo las enzimas afectan la belleza y la salud. Recuperado de https://www.huffingtonpost.com/kimberly-snyder/enzymes-beauty-health_b_1201847.html
15. IBID-Pugliese pg 391
16., IBID-Lavrikova p 7
17. Preland, R., Rothnagel, J., Lawrence, O. (2006) Capítulo 9, Profilaggrin and the Fused S100 Family of Calcium-Binding Proteins. Barrera cutánea, Elias & Feingold.18. Ekholm, E., Brattasnd, M., Egelrud, T. (Jan. 2000) stratum Corneum Tryptic Enzyme in Normal Epidermis: A Missing Link in the Descamation Process? Journal of Investigative Dermatology, Vol 114, Issue 1, PP 56-63 Retrieved from https://www.sciencedirect.com/science/article/pii/S0022202X15407316
19. IBID-Pugliese-Ref 1
20. IBID-Ref 17, p. 56