Obiettivi di Apprendimento
alla fine di questa sezione, si sarà in grado di:
- Definire ionici e molecolari (covalente) composti
- Predire il tipo di composto formato da elementi in base alla loro posizione all’interno della tavola periodica
- Determinare le formule di semplici composti ionici
In ordinarie reazioni chimiche, il nucleo di ogni atomo (e quindi l’identità dell’elemento) rimane invariato., Gli elettroni, tuttavia, possono essere aggiunti agli atomi per trasferimento da altri atomi, persi per trasferimento ad altri atomi o condivisi con altri atomi. Il trasferimento e la condivisione di elettroni tra atomi governano la chimica degli elementi. Durante la formazione di alcuni composti, gli atomi guadagnano o perdono elettroni e formano particelle cariche elettricamente chiamate ioni (Figura 1).
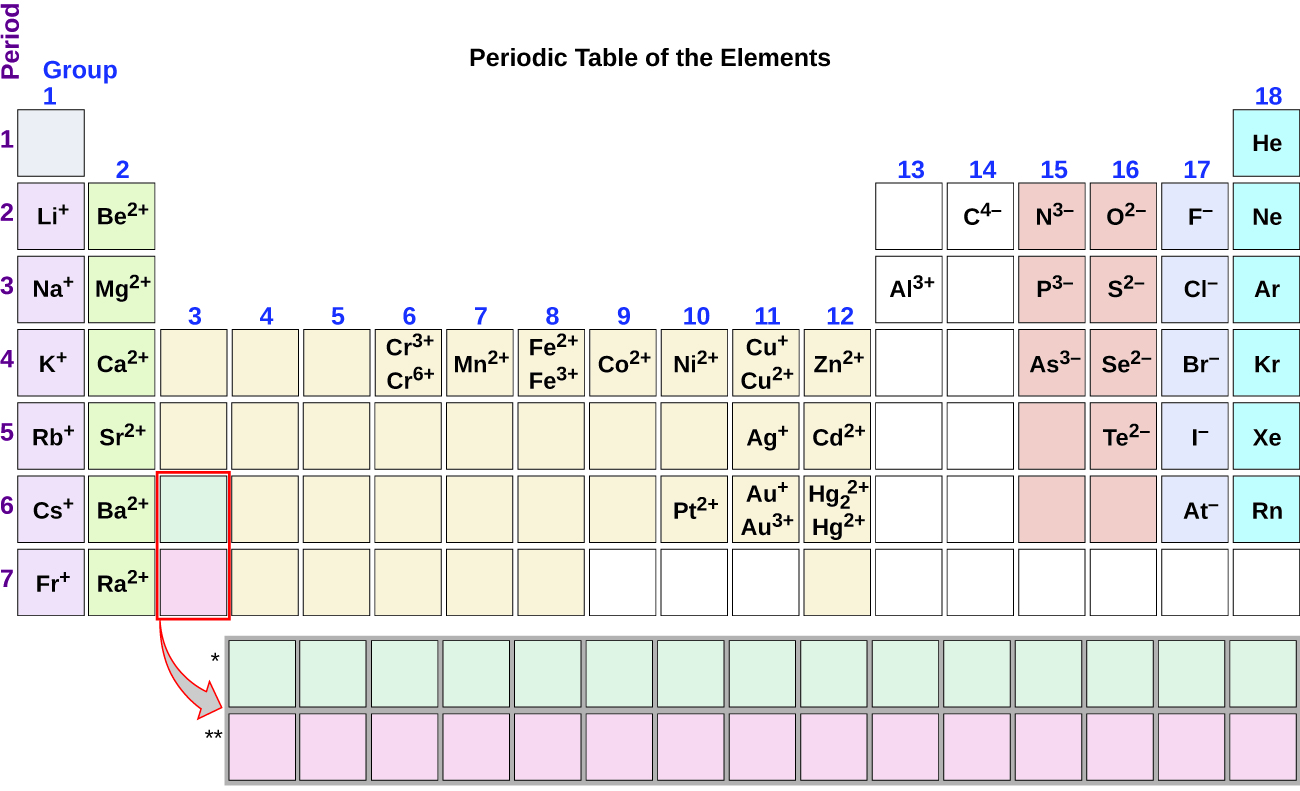
È possibile utilizzare la tavola periodica per prevedere se un atomo formerà un anione o un catione e spesso è possibile prevedere la carica dello resulting risultante., Gli atomi di molti metalli del gruppo principale perdono abbastanza elettroni da lasciarli con lo stesso numero di elettroni di un atomo del precedente gas nobile. Per illustrare, un atomo di un metallo alcalino (gruppo 1) perde un elettrone e forma un catione con una carica 1+; un metallo alcalino terroso (gruppo 2) perde due elettroni e forma un catione con una carica 2+ e così via. Ad esempio, un atomo di calcio neutro, con 20 protoni e 20 elettroni, perde facilmente due elettroni. Ciò si traduce in un catione con 20 protoni, 18 elettroni e una carica 2+., Ha lo stesso numero di elettroni come atomi del precedente gas nobile, argon, ed è simboleggiato Ca2+. Il nome di uno ion metallico è lo stesso del nome dell’atomo metallico da cui si forma, quindi Ca2+ è chiamato ion calcio.
Quando gli atomi di elementi non metallici formano ioni, generalmente guadagnano abbastanza elettroni da dare loro lo stesso numero di elettroni di un atomo del prossimo gas nobile nella tavola periodica. Gli atomi del gruppo 17 guadagnano un elettrone e formano anioni con una carica 1; gli atomi del gruppo 16 guadagnano due elettroni e formano ioni con una carica 2 e così via., Ad esempio, l’atomo di bromo neutro, con 35 protoni e 35 elettroni, può ottenere un elettrone per fornirgli 36 elettroni. Ciò si traduce in un anione con 35 protoni, 36 elettroni e una carica 1. Ha lo stesso numero di elettroni come atomi del prossimo gas nobile, krypton, ed è simboleggiato Br−. (Una discussione della teoria che supporta lo stato favorito dei numeri di elettroni del gas nobile riflessa in queste regole predittive per la formazione di ioni è fornita in un capitolo successivo di questo testo.)
Si noti l’utilità della tavola periodica nel predire la probabile formazione di ioni e la carica (Figura 2)., Spostandosi dall’estrema sinistra a destra sulla tavola periodica, gli elementi del gruppo principale tendono a formare cationi con una carica uguale al numero del gruppo. Cioè, gli elementi del gruppo 1 formano 1 + ioni; gli elementi del gruppo 2 formano 2+ ioni e così via. Spostandosi dall’estrema destra a sinistra sulla tavola periodica, gli elementi spesso formano anioni con una carica negativa pari al numero di gruppi spostati a sinistra dai gas nobili. Ad esempio, gli elementi del gruppo 17 (un gruppo a sinistra dei gas nobili) formano 1− ioni; gli elementi del gruppo 16 (due gruppi a sinistra) formano 2− ioni e così via., Questa tendenza può essere utilizzata come guida in molti casi, ma il suo valore predittivo diminuisce quando si sposta verso il centro della tavola periodica. Infatti, i metalli di transizione e alcuni altri metalli spesso presentano cariche variabili che non sono prevedibili dalla loro posizione nella tabella. Ad esempio, il rame può formare ioni con una carica 1+ o 2+ e il ferro può formare ioni con una carica 2+ o 3+.
Esempio 1
Composizione degli ioni
Uno ion trovato in alcuni composti usati come antitraspiranti contiene 13 protoni e 10 elettroni. Qual è il suo simbolo?
Soluzione
Poiché il numero di protoni rimane invariato quando un atomo forma uno ion, il numero atomico dell’elemento deve essere 13. Sapendo questo ci permette di utilizzare la tavola periodica per identificare l’elemento come Al (alluminio). L’atomo di Al ha perso tre elettroni e quindi ha tre cariche più positive (13) di quanto non abbia elettroni (10). Questo è il catione di alluminio, Al3+.,
Controlla il tuo apprendimento
Dai il simbolo e il nome per lo ion con 34 protoni e 36 elettroni.
Risposta:
Se2−, lo sel selenide
Esempio 2
Formazione di ioni
Il magnesio e l’azoto reagiscono per formare un composto ionico. Prevedere quale forma un anione, che forma un catione e le cariche di ciascun ion. Scrivi il simbolo per ogni ion e chiamali.
Soluzione
La posizione del magnesio nella tavola periodica (gruppo 2) ci dice che è un metallo. I metalli formano ioni positivi (cationi)., Un atomo di magnesio deve perdere due elettroni per avere lo stesso numero di elettroni di un atomo del precedente gas nobile, neon. Quindi, un atomo di magnesio formerà un catione con due elettroni in meno rispetto ai protoni e una carica di 2+. Il simbolo per lo ion è Mg2+, ed è chiamato ion magnesio.
La posizione dell’azoto nella tavola periodica (gruppo 15) rivela che è un metalloide. I non metalli formano ioni negativi (anioni). Un atomo di azoto deve guadagnare tre elettroni per avere lo stesso numero di elettroni di un atomo del seguente gas nobile, neon., Quindi, un atomo di azoto formerà un anione con tre elettroni in più rispetto ai protoni e una carica di 3−. Il simbolo per lo ion è N3 -, ed è chiamato ion nitruro.
Controlla il tuo apprendimento
Alluminio e carbonio reagiscono per formare un composto ionico. Prevedere quale forma un anione, che forma un catione e le cariche di ciascun ion. Scrivi il simbolo per ogni ion e chiamali.
Risposta:
Al formerà un catione con una carica di 3+: Al3+, uno ion di alluminio. Il carbonio formerà un anione con una carica di 4−: C4 -, uno carbide di carburo.,
Gli ioni che abbiamo discusso finora sono chiamati ioni monatomici, cioè sono ioni formati da un solo atomo. Troviamo anche molti ioni poliatomici. Questi ioni, che agiscono come unità discrete, sono molecole cariche elettricamente (un gruppo di atomi legati con una carica complessiva). Alcuni degli ioni poliatomici più importanti sono elencati nella tabella 6. Gli ossianioni sono ioni poliatomici che contengono uno o più atomi di ossigeno. A questo punto nel tuo studio della chimica, dovresti memorizzare i nomi, le formule e le cariche degli ioni poliatomici più comuni., Poiché li userai ripetutamente, presto diventeranno familiari.
Si noti che esiste un sistema per nominare alcuni ioni poliatomici; -ate e-ite sono suffissi che designano ioni poliatomici contenenti più o meno atomi di ossigeno. Per – (abbreviazione di “iper”) e hypo- (che significa “sotto”) sono prefissi che significano rispettivamente più atomi di ossigeno di-ate e meno atomi di ossigeno di-ite. Ad esempio, il perclorato è ClO4−, il clorato è ClO3−, il clorito è ClO2− e l’ipoclorito è ClO−., Sfortunatamente, il numero di atomi di ossigeno corrispondenti a un dato suffisso o prefisso non è coerente; ad esempio, il nitrato è NO3− mentre il solfato è SO42−. Questo sarà trattato in modo più dettagliato nel prossimo modulo sulla nomenclatura.
La natura delle forze attrattive che tengono insieme atomi o ioni all’interno di un composto è la base per classificare il legame chimico. Quando gli elettroni vengono trasferiti e gli ioni si formano, i legami ionici risultano., I legami ionici sono forze elettrostatiche di attrazione, cioè le forze attrattive sperimentate tra oggetti di carica elettrica opposta (in questo caso cationi e anioni). Quando gli elettroni sono “condivisi” e le molecole si formano, risultano legami covalenti. I legami covalenti sono le forze attrattive tra i nuclei caricati positivamente degli atomi legati e una o più coppie di elettroni che si trovano tra gli atomi. I composti sono classificati come ionici o molecolari (covalenti) sulla base dei legami presenti in essi.,
Quando un elemento composto da atomi che perdono facilmente elettroni (un metallo) reagisce con un elemento composto da atomi che guadagnano facilmente elettroni (un metalloide), di solito si verifica un trasferimento di elettroni, producendo ioni. Il composto formato da questo trasferimento è stabilizzato dalle attrazioni elettrostatiche (legami ionici) tra gli ioni di carica opposta presenti nel composto., Per esempio, quando ogni atomo di sodio in un campione di sodio metallico (gruppo 1) cede un elettrone per formare un catione sodio, Na+, e ogni atomo di cloro in un campione di gas di cloro (gruppo 17) accetta un elettrone per formare un anione cloruro, Cl−, il composto ottenuto, NaCl, è composto da ioni sodio e ioni cloruro nel rapporto di Na+ ione per ogni Cl− ion. Allo stesso modo, ogni atomo di calcio (gruppo 2) può cedere due elettroni e trasferire uno a ciascuno dei due atomi di cloro per formare CaCl2, che è composto da Ca2+ e Cl− ioni nel rapporto di uno Ca Ca2+ a due Cl− ioni.,
Un composto che contiene ioni ed è tenuto insieme da legami ionici è chiamato composto ionico. La tavola periodica può aiutarci a riconoscere molti dei composti che sono ionici: quando un metallo è combinato con uno o più non metalli, il composto è solitamente ionico. Questa linea guida funziona bene per prevedere la formazione di composti ionici per la maggior parte dei composti tipicamente incontrati in un corso introduttivo di chimica. Tuttavia, non è sempre vero (ad esempio, il cloruro di alluminio, AlCl3, non è ionico).
È spesso possibile riconoscere i composti ionici a causa delle loro proprietà., I composti ionici sono solidi che in genere si sciolgono a temperature elevate e bollono a temperature ancora più elevate. Ad esempio, il cloruro di sodio si scioglie a 801 °C e bolle a 1413 °C. (Come confronto, l’acqua del composto molecolare si scioglie a 0 °C e bolle a 100 °C.) In forma solida, un composto ionico non è elettricamente conduttivo perché i suoi ioni non sono in grado di fluire (“elettricità” è il flusso di particelle cariche). Quando fuso, tuttavia, può condurre elettricità perché i suoi ioni sono in grado di muoversi liberamente attraverso il liquido (Figura 3).,


Guarda questo video per vedere una miscela di sali fondere e condurre l’elettricità.
In ogni composto ionico, il numero totale di cariche positive dei cationi è uguale al numero totale di cariche negative degli anioni., Pertanto, i composti ionici sono complessivamente elettricamente neutri, anche se contengono ioni positivi e negativi. Possiamo usare questa osservazione per aiutarci a scrivere la formula di un composto ionico. La formula di un composto ionico deve avere un rapporto di ioni tale che il numero di cariche positive e negative siano uguali.
Esempio 3
Predire la formula di un composto ionico
Lo zaffiro della pietra preziosa (Figura 4) è principalmente un composto di alluminio e ossigeno che contiene cationi di alluminio, Al3+ e anioni di ossigeno, O2−. Qual è la formula di questo composto?,

Soluzione
Poiché il composto ionico deve essere elettricamente neutro, deve avere lo stesso numero di cariche positive e negative., Due ioni di alluminio, ciascuno con una carica di 3+, ci darebbero sei cariche positive e tre ioni di ossido, ciascuno con una carica di 2 -, ci darebbero sei cariche negative. La formula sarebbe Al2O3.
Controlla il tuo apprendimento
Prevedere la formula del composto ionico formato tra il catione di sodio, Na+, e l’anione solfuro, S2 -.
Risposta:
Na2S
Molti composti ionici contengono ioni poliatomici (Tabella 6) come catione, anione o entrambi., Come per i composti ionici semplici, anche questi composti devono essere elettricamente neutri, quindi le loro formule possono essere previste trattando gli ioni poliatomici come unità discrete. Usiamo parentesi in una formula per indicare un gruppo di atomi che si comportano come unità. Ad esempio, la formula per il fosfato di calcio, uno dei minerali nelle nostre ossa, è Ca3(PO4)2. Questa formula indica che ci sono tre ioni di calcio (Ca2+) per ogni due gruppi di fosfato (PO43−). I gruppi PO43 sono unità discrete, ciascuna composta da un atomo di fosforo e quattro atomi di ossigeno, e con una carica complessiva di 3−., Il composto è elettricamente neutro e la sua formula mostra un conteggio totale di tre atomi Ca, due P e otto O.
Esempio 4
Predire la formula di un composto con un anione poliatomico
Il lievito contiene calcio diidrogeno fosfato, un composto ionico composto dagli ioni Ca2+ e H2PO4−. Qual è la formula di questo composto?
Soluzione
Le cariche positive e negative devono essere bilanciate e questo composto ionico deve essere elettricamente neutro. Quindi, dobbiamo avere due cariche negative per bilanciare la carica 2+ dello calcium calcio., Ciò richiede un rapporto di uno Ca Ca2 + a due ioni H2PO4. Designiamo questo racchiudendo la formula per lo ion diidrogeno fosfato tra parentesi e aggiungendo un pedice 2. La formula è Ca (H2PO4) 2.
Controlla il tuo apprendimento
Prevedere la formula del composto ionico formato tra lo lithium litio e lo ion perossido, O22- (Suggerimento: Utilizzare la tavola periodica per prevedere il segno e la carica sullo lithium litio.,)
Risposta:
Li2O2
Poiché un composto ionico non è costituito da singole molecole discrete, potrebbe non essere correttamente simboleggiato usando una formula molecolare. Invece, i composti ionici devono essere simboleggiati da una formula che indica i numeri relativi dei suoi ioni costituenti. Per i composti contenenti solo ioni monatomici (come NaCl) e per molti composti contenenti ioni poliatomici (come CaSO4), queste formule sono solo le formule empiriche introdotte in precedenza in questo capitolo., Tuttavia, le formule per alcuni composti ionici contenenti ioni poliatomici non sono formule empiriche. Ad esempio, l’ossalato di sodio composto ionico è composto da Na+ e C2O42− ioni combinati in un rapporto 2:1 e la sua formula è scritta come Na2C2O4. I pedici in questa formula non sono i numeri interi più piccoli possibili, poiché ciascuno può essere diviso per 2 per ottenere la formula empirica, NaCO2. Questa non è la formula accettata per l’ossalato di sodio, tuttavia, in quanto non rappresenta accuratamente l’anione poliatomico del composto, C2O42−.,
Composti molecolari
Molti composti non contengono ioni ma consistono esclusivamente di molecole discrete e neutre. Questi composti molecolari (composti covalenti) risultano quando gli atomi condividono, piuttosto che trasferire (guadagnare o perdere), elettroni. Il legame covalente è un concetto importante ed esteso in chimica, e sarà trattato in modo molto dettagliato in un capitolo successivo di questo testo. Spesso possiamo identificare i composti molecolari sulla base delle loro proprietà fisiche., In condizioni normali, i composti molecolari spesso esistono come gas, liquidi a basso punto di ebollizione e solidi a basso punto di fusione, sebbene esistano molte eccezioni importanti.
Mentre i composti ionici si formano solitamente quando un metallo e un metalloide si combinano, i composti covalenti sono solitamente formati da una combinazione di non metalli. Pertanto, la tavola periodica può aiutarci a riconoscere molti dei composti che sono covalenti., Mentre possiamo usare le posizioni degli elementi di un composto nella tavola periodica per prevedere se è ionico o covalente a questo punto nel nostro studio della chimica, dovresti essere consapevole che questo è un approccio molto semplicistico che non tiene conto di una serie di eccezioni interessanti. Sfumature di grigio esistono tra composti ionici e molecolari, e imparerai di più su quelli più tardi.,
5
Prevedere il Tipo di Legame nei Composti
Prevedere se i seguenti composti sono ionica o molecolare:
(a) KI, il composto utilizzato come fonte di iodio nel sale da tavola
(b) H2O2, la candeggina e disinfettante perossido di idrogeno
(c) CHCl3, l’anestetico cloroformio
(d) Li2CO3, fonte di litio in antidepressive
Soluzione
(a) Potassio (gruppo 1) è un metallo, e lo iodio (gruppo 17) è un metalloide; KI è previsto per essere ionica.,
(b) L’idrogeno (gruppo 1) è un metalloide e l’ossigeno (gruppo 16) è un metalloide; si prevede che H2O2 sia molecolare.
(c) Il carbonio (gruppo 14) è un metalloide, l’idrogeno (gruppo 1) è un metalloide e il cloro (gruppo 17) è un metalloide; si prevede che CHCl3 sia molecolare.
(d) Il litio (gruppo 1) è un metallo e il carbonato è uno ion poliatomico; si prevede che Li2CO3 sia ionico.,
Verifica il Tuo Apprendimento
Utilizzando la tavola periodica, prevedere se i seguenti composti ionici o covalenti:
(a) SO2
(b) CaF2
(c) N2H4
(d) Al2(SO4)3
Risposta:
(a) molecolare; (b) ionico; (c) molecolare; (d) ionico
Concetti Chiave e Sintesi
Metalli (in particolare quelli dei gruppi 1 e 2) tendono a perdere il numero di elettroni che avrebbe permesso loro con lo stesso numero di elettroni, come nel precedente, un gas nobile, nella tavola periodica. In questo modo si forma uno ion caricato positivamente., Allo stesso modo, i non metalli (specialmente quelli dei gruppi 16 e 17 e, in misura minore, quelli del Gruppo 15) possono ottenere il numero di elettroni necessari per fornire agli atomi lo stesso numero di elettroni del prossimo gas nobile nella tavola periodica. Pertanto, i non metalli tendono a formare ioni negativi. Gli ioni caricati positivamente sono chiamati cationi e gli ioni caricati negativamente sono chiamati anioni. Gli ioni possono essere monatomici (contenenti un solo atomo) o poliatomici (contenenti più di un atomo).
I composti che contengono ioni sono chiamati composti ionici., I composti ionici generalmente si formano da metalli e non metalli. I composti che non contengono ioni, ma consistono invece di atomi legati strettamente insieme in molecole (gruppi di atomi non caricati che si comportano come una singola unità), sono chiamati composti covalenti. I composti covalenti di solito si formano da due non metalli.,lar composto) composto da molecole formate da atomi di due o più elementi diversi legame ionico forze elettrostatiche di attrazione tra ioni di carica opposta di un composto ionico ionico composto composto composto di cationi e anioni combinati in proporzioni che si concretizza in un elettricamente neutro sostanza molecolare del composto (anche, composto covalente) composto da molecole formate da atomi di due o più elementi diversi monoatomico ion ion composto da un singolo atomo oxyanion polyatomic anione composto da un atomo centrale legato ad atomi di ossigeno polyatomic ion ion composto da più di un atom